איידס
 | |
| הסרט האדום הפך לסמל המאבק העולמי במחלת האיידס | |
| תחום |
מחלות זיהומיות |
|---|---|
| מיקום אנטומי |
לימפוציט T |
| גורם |
HIV |
| תסמינים |
חום, כאבי שרירים, night sweats, נוירופתיה פריפרית, כאב גרון, enlargement of lymph nodes, עייפות, אפתה, לימפומה, זיהום אופורטוניסטי, שלשול, לימפדנופתיה, סרקומת קפושי, lethargy, פריחה, ירידה במשקל, צמרמורת |
| טיפול |
|
| קישורים ומאגרי מידע | |
| eMedicine | article/211316 |
| DiseasesDB | 5938 |
| MeSH | D000163 |
| MedlinePlus | 000594 |
| סיווגים | |
| ICD-10 | B24 |
| ICD-11 |
1C62.3 |
איידס (AIDS; ראשי תיבות באנגלית: Acquired Immune Deficiency Syndrome, תסמונת הכשל החיסוני הנרכש) הוא אוסף תסמינים, המופיעים בשל כשל של מערכת החיסון בעקבות הידבקות בנגיף ה-HIV. החולים סובלים מזיהומים אופורטוניסטים ומגידולים, שניהם מסכני חיים. על פי ההערכות, יותר מ-25 מיליון בני אדם מתו מהמחלה ב-30 השנים האחרונות. החל מאמצע שנות ה-90 קיים טיפול תרופתי המונע את התפרצות המחלה ומאפשר לנשאים לחיות עם נגיף ה-HIV באופן כמעט זהה למי שאינו נושא את הנגיף. על כן כיום נשאות של HIV נחשבת לסטטוס כרוני, ולא למחלה סופנית.[1]
היסטוריה
[עריכת קוד מקור | עריכה]מחלת האיידס התגלתה במדינות המערב בסוף שנות ה-70 של המאה ה-20, ומאז הפכה לאחת המחלות המדוברות והנחקרות ביותר. המחלה זוהתה לראשונה בשנת 1981. הנגיף הגורם למחלה זוהה לראשונה בשנת 1983. בשנת 2008 הוענק לחוקרים פרנסואז בארה-סינוסי ולוק מונטנייה מצרפת פרס נובל לפיזיולוגיה או לרפואה על גילוי נגיף ה-HIV, הגורם למחלת האיידס.
ארגון הבריאות העולמי מעריך שכ-36 מיליון בני אדם מתו עד סוף 2012 מהמחלה. המצב חמור במיוחד באפריקה שמדרום לסהרה, ובעיקר בדרום אפריקה ובסביבותיה, שם כ-20% מהתושבים הבוגרים הם נשאים של נגיף ה-HIV הגורם למחלה.
המחלה עודנה חשוכת מרפא, על אף מאמצים גדולים למצוא לה תרופה או חיסון. מאז אמצע שנות ה-90, עם מציאתן של שלוש תרופות שניתנות כיום יחדיו ומכונות בשם "קוקטייל", מוארכים חיי החולים באופן משמעותי. תוחלת החיים של נשאים המטופלים על פי סטנדרטים מערביים אומנם נמוכה מזו של מי שאינו נשא, אך היא די גבוהה והם יכולים להגיע לגיל מבוגר גם אם נדבקו בצעירותם.[2] לעומת זאת, כאשר הטיפול הרפואי אינו בהישג יד (לרוב במדינות העולם השלישי), מתים מרבית החולים בשנים הראשונות שלאחר האבחון.
שלבי המחלה ופתופיזיולוגיה
[עריכת קוד מקור | עריכה]אפיון כללי
[עריכת קוד מקור | עריכה]
משמה של מחלת ה-AIDS ניתן ללמוד על אופייה: באנגלית : Acquired Immune Deficiency Syndrome
- תסמונת, כיוון שאיידס משפיעה על מערכות רבות בגוף, אין לה תסמין בודד וחד-משמעי.
- כשל חיסוני, קבוצה של מחלות שבהן קיים אי-תפקוד חמור של מערכת החיסון.
- נרכש, כיוון שהמחלה אינה תורשתית אלא נגרמת על ידי נגיף.
נגיף HIV
[עריכת קוד מקור | עריכה] ערך מורחב – HIV
ערך מורחב – HIV
HIV הוא נגיף מסוג רטרו וירוס (כלומר, החומר התורשתי שבו הוא RNA חד-גדילי חיובי שמתועתק ל-DNA באמצעות שעתוק לאחור), וקרוי HIV (ראשי תיבות באנגלית של Human Immunodeficiency Virus, "נגיף הכשל החיסוני האנושי"). HIV תוקף את תאי הדם הלבנים, אשר תפקידם הוא לאתר חיידקים, נגיפים ותאים סרטניים בגוף ו"לקרוא" לתאי דם לבנים אחרים להילחם בהם. מערכת החיסון של אדם החולה באיידס דומה אפוא לצבא גדול וחזק שאינו מקבל פקודה לתקוף ועל כן אינו תוקף. יכולת ההגנה העצמית של הגוף נמחקת למעשה על ידי הנגיף, והחולה מת לבסוף ממחלות שבאופן נורמלי הגוף היה מסוגל להתמודד עמן ללא קושי, כגון שפעת ודלקת ריאות. גם סוגי סרטן מסוימים (בעיקר סרקומה, סרטן רקמות החיבור) נפוצים בקרב חולי איידס, כיוון שתאי הדם הלבנים באדם בריא מסוגלים להשמיד אף תאים סרטניים.
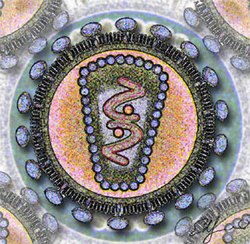
לאחר ההדבקה
[עריכת קוד מקור | עריכה]בקרב כ-50% עד 80% מהנדבקים מופיעים תסמיני שפעת במהלך החודשיים הראשונים שלאחר ההדבקה, דבר המעיד על ניסיונה הראשוני של מערכת החיסון להילחם בנגיף (ראו: דלקת). התסמינים כוללים חום, בחילה ופריחה קלה על העור. בנוסף עלולה להתפתח דלקת קרום המוח קלה. מספרם של תאי ה-T המסייעים בדם משתנה במהירות: באדם בריא נספרים בממוצע כ-700 עד 1,200 תאי T למיקרוליטר דם. במהלך החודשיים הראשונים צונחת ספירת תאי ה-T לכ-400 תאים למק"ל בלבד, ובסוף התקופה, לאחר שתסמיני השפעת חולפים, מתייצבת הספירה על כ-700 תאים למק"ל.
בשלב הראשון, הנגיף פולש לתאים דנדריטיים; לאחר מכן נודדים התאים הדנדריטיים ובתוכם הנגיף אל קשרי הלימפה, שם נוצר המפגש הראשוני בין הנגיף ובין תאי T. הנגיף נשאר לעיתים קרובות רדום בתאים דנדריטיים, במקרופאג'ים ובתאי T בלתי-מופעלים. תאים אלו יכולים להישאר מודבקים במשך שנים ארוכות, גם לאחר שתרופות הצליחו למגר את הנגיפים בשאר התאים (ראו להלן: טיפול).
דגירה
[עריכת קוד מקור | עריכה]משכו של שלב הדגירה קשה לחיזוי, והוא נע בין שנתיים ל-15 שנים. במהלך שלב זה, שבו קרוי החולה נשא, על פי רוב, הנשא אינו מרגיש כל תחושת חולי, כך שללא טיפול תרופתי, מתרבה הנגיף במהירות, אך ספירת תאי ה-T אינה יורדת אל מתחת ל-500 תאים למק"ל, כך שמערכת החיסון מסוגלת עדיין להילחם בהצלחה בזיהומים משניים התוקפים את הגוף. משך הדגירה שונה מאדם לאדם; הדבר תלוי בזני הנגיף הנמצאים בגוף, בכושרה הכללי של מערכת החיסון של החולה, בפרופיל הגנטי שלו ובמידת חשיפתו לזיהומים.
השלב התסמיני
[עריכת קוד מקור | עריכה]
שלב זה ("ההתפרצות") מתחיל כשספירת תאי ה-T צונחת אל מתחת ל-500 תאים למק"ל. משלב זה מתחילה מלחמה קשה ואבודה מראש עם המחלה. בתחילת שלב זה תוקף הנגיף את המקרופאג'ים, המרכיב העיקרי של מערכת החיסון המולדת (כלומר, המרכיב במערכת החיסון אשר תוקף פתוגנים ללא כל אבחנה). כבר אז מורגשת ירידה ביכולת החיסונית של הגוף, שכן המקרופאג'ים מהווים מחסום ראשוני חשוב בפני פתוגנים.
לאחר מכן חודר הנגיף לתאי דם לבנים המציגים על גבי הממברנה שלהם קולטן הקרוי CD4. תאים העונים לקריטריון זה הם מונוציטים, תאים דנדריטיים ובעיקר: לימפוציטים מסייעים מסוג T (באנגלית: Helper T cells). הנגיף נצמד לקולטן שעל גבי הממברנה ולאחר מכן חודר אל תוך התא. הנגיף, המכיל כאמור RNA, משתמש באנזים המצוי בקפסיד (הקופסית החלבונית העוטפת את החומר התורשתי) של הנגיף: רוורס טרנסקריפטאז. האנזים מבצע "שעתוק לאחור" - ויוצר סליל כפול של DNA מהסליל הבודד של RNA. ה-DNA שנוצר משתלב בכרומוזומים של הלימפוציט ומאוחר יותר משועתק ל-RNA, אשר בתורו מתורגם לחלבונים, כפי שמתרחש עם כל אחד מהגנים הרגילים שמרכיבים את החומר התורשתי של הלימפוציט.
תרגום הגנום הנגיפי (הכולל בסך-הכל 9 גנים) גורם ליצירת עותקים רבים של הנגיף בתוך הלימפוציט. ה-RNA הנגיפי מכיל, למעשה, "הוראות הרכבה" ליצירת נגיפים חדשים. הנגיף מנצל את מנגנון השכפול של הלימפוציט (שכן לנגיפים אין מנגנון שכפול עצמאי), משתכפל בצורה מסיבית וגורם למותו של הלימפוציט. לאחר מכן גורמים הנגיפים החדשים להרס ממברנת הלימפוציט; עתה יכולים הנגיפים לצאת מן התא ולהדביק לימפוציטים חדשים. במונוציטים ובתאים דנדריטיים משתכפל הנגיף גם כן, אך בדרך-כלל אינו מביא למות התא. תאים אלו מהווים, אם כן, מעין מאגר של נגיפים.
בחודשים הראשונים להידבקות מנסה מערכת החיסון להתמודד עם הנגיף, ומייצרת תאי B, אשר בתורם מייצרים נוגדנים הנצמדים לנגיף ומביאים להשמדתו. בהמשך, מערכת החיסון אינה מסוגלת יותר לעמוד בעומס, המוערך ב-109 לימפוציטים מודבקים בכל יום וב-1010 נגיפים חדשים המיוצרים בכל יום. כמעט כל הלימפוציטים הנגועים שוכנים בקשרי הלימפה.
איידס
[עריכת קוד מקור | עריכה]אדם מוגדר כחולה באיידס כשספירת תאי ה-+CD4 שלו נמוכה מ-200 תאים למק"ל; למרות זאת, תסמינים וזיהומים משניים מופיעים כבר לפני כן (כשהספירה נמוכה מ-500 תאים למק"ל), כפי שצוין לעיל. כ-80% מחולי האיידס הלא מטופלים נפטרים תוך חמש שנים מרגע הגדרתם כחולי איידס; רבים מהם מתים לפני כן. אך יש שנושאים את המחלה, אף ללא טיפול, גם 20 שנה. מותם של תאי ה-T המסייעים נגרם בשלוש דרכים:
- חיסול ישיר של התאים על ידי נגיפים שפלשו אליהם.
- עידוד אפופטוזה של התאים על ידי נגיפים שפלשו אליהם.
- חיסול תאי ה-T הנגועים על ידי תאי T ציטוטוקסיים.
זיהומים ומוות
[עריכת קוד מקור | עריכה]
שיאה של מחלת האיידס הוא דיכויה של מערכת החיסון וכתוצאה מכך הידבקות בפתוגנים אופורטוניסטיים - מיקרואורגניזמים אשר נמצאים בסביבת האדם או בגופו כמעט תמיד, אך המעוררים מחלות רק במצב של כשל חיסוני. לא כל פתוגן מסוגל להדביק חולי איידס; רכיבים רבים של מערכת החיסון אינם נפגעים כתוצאה מהמחלה, וחולי איידס נדבקים רק בפתוגנים המחוסלים בדרך כלל על ידי התגובה החיסונית התאית (כלומר, התגובה החיסונית המופעלת על ידי תאים, כגון תאי T מסייעים ומקרופאג'ים, זאת בניגוד לתגובה החיסונית ההומוראלית, המופעלת על ידי חלקיקים הזורמים בדם ובלימפה - בעיקר נוגדנים).
הידבקות בפתוגנים מתחילה בשלב התסמיני (ראו לעיל). בתחילה מופיעים זיהומים הנגרמים על ידי הפטרייה Candida albicans. הפטרייה גורמת לפּטֶרֶת הפה (כיסוי מסיבי של חלל הפה במושבות של הפטרייה), לדלקת ריאות קלה ולדלקת הוושט. בנוסף מתרחשת הדבקה בחיידק Mycobacterium tuberculosis, הגורם לשחפת, ובחיידק אחר מאותו הסוג, M. avium, העלול לגרום למחלת קרוהן. הישנות מחלת השחפת שכיחה הרבה יותר בנשאי HIV הסובלים מחוסר ברזל בפלזמה, מאשר בנשאי HIV שרמת הברזל בדמם תקינה, ושיעור התמותה שלהם גבוה יותר באופן מובהק.[3] לכן מומלץ לנשאי HIV הסובלים מחוסר ברזל ונדבקו בשחפת ליטול תוספי ברזל מתאימים.
בהמשך מופיעים הנגיפים Varicella zoster ו-Herpes simplex, הגורמים למחלת המין שלבקת (הרפס). שני נגיפים נוספים ממשפחת ההרפס הם "ציטומגלווירוס" (בקיצור: CMV; סוג בעל כמה מינים) ונגיף אפשטיין בר (Epstein-Barr; בקיצור: EBV), שניהם גורמים למחלת הנשיקה. הנגיף האחרון מעודד גם לימפומה על-שם ברקיט, סוג של סרטן הלימפה. סרקומת קפוסי היא סרטן של כלי הדם ורקמות החיבור, אשר עד להופעת האיידס היה נדיר ביותר. סרטן זה, הנגרם לעיתים על ידי נגיף ההרפס, מופיע בחולי איידס בשכיחות הגבוהה עשרות מונים מזו של האוכלוסייה הבריאה. הסרטן גורם לשלפוחיות כהות בעור ולעיתים לדימומים פנימיים בגוף - זהו גורם המוות העיקרי מהמחלה.
נגיף ממשפחת הפוליומה, המכונה נגיף JC, גורם לחולי מוח מתקדם רב-מוקדי (PML), מחלה קשה הגורמת לניוון המוח, לירידה קוגניטיבית, לשיתוק, להפרעות ראייה ולמוות מהיר (תוך כארבעה חודשים). הנגיף שכיח מאוד ונמצא בגופם של כ-70% מכל בני האדם, אך גורם ל-PML רק בחולים בעלי כשל חיסוני; בין 2% ל-7% מחולי האיידס מתים מ-PML. זיהומים נוספים של מערכת העצבים המרכזית נגרמים על ידי הפטרייה Cryptococcus neoformans והפרוטיסט Toxoplasma gondii.
בעבר הייתה דלקת ריאות גורם המוות העיקרי מאיידס. נגיפים וחיידקים רבים עלולים לגרום למחלה, ביניהם הפטרייה Pneumocystis jiroveci וחיידקי המיקובקטריה שהוזכרו לעיל. טיפול מונע באנטיביוטיקה ופיתוח תרופות אנטי-פטרייתיות חדישות הביאו לירידה בשיעור המוות מדלקת ריאות בחולי איידס. פתוגנים רבים גורמים לשלשול חמור בחולי איידס: החיידק Salmonella, הגורם לטיפוס הבטן והפרוטיסטים Cryptosporidium ו-Isospora, למשל. השלשול החמור, המביא גם לאיבוד משקל, הוא אחד הגורמים העיקריים למוות בחולי איידס במדינות העולם השלישי.
עמידות בפני HIV
[עריכת קוד מקור | עריכה]
הנגיף נקשר באופן כימי לכמה קולטנים הנמצאים על גבי ממברנת הלימפוציט. אצל אנשים מסוימים חלה מוטציה בגן המקודד לייצור אחד הקולטנים (אשר תפקידו לקלוט כימוקינים), CCR5, ולפיכך הקולטן אינו מיוצר בגופם. היעדר הקולטן אינו גורם לתופעות שליליות, והיכולת החיסונית של האדם אינה נפגמת. לעומת זאת, דווקא היעדר הקולטן באנשים אלו מקנה להם עמידות בפני איידס; נגיף ה-HIV אינו מסוגל להיצמד אצל אנשים אלה לממברנת הלימפוציטים, ולפיכך הם אינם יכולים לחלות במחלה.
במוטציה המוזכרת לעיל קיים חֶסֶר של 32 נוקלאוטידים בגן המקודד ל-CCR5. המוטציה מועברת בתורשה באופן אוטוזומי רצסיבי (ראו גם: פגם גנטי). הומוזיגוטים (אנשים בעלי שני אללים פגומים) אינם מייצרים את הקולטן כלל, ועמידים לפיכך בפני המחלה; הטרוזיגוטים (אנשים בעלי אלל אחד תקין ואלל אחד פגום) מייצרים את הקולטן בכמות מועטה. הם עשויים להידבק באיידס, אלא שמהלך המחלה אצלם איטי בצורה ניכרת מהרגיל.
כמות הקולטן CCR5 על גבי ממברנות הלימפוציטים אינה קבועה. המנגנון הגנטי של הלימפוציטים מצויד במנגנוני בקרה אשר מעודדים או מעכבים את ייצור הקולטן על פי הצורך. כשפתוגנים פולשים לגוף, מיוצרת כמות רבה יותר של קולטנים; לימפוציטים בעלי מספר רב של קולטנים חשופים יותר לתקיפה על ידי HIV, שכן עתה מסוגל הנגיף להיצמד טוב יותר אל הלימפוציט. הסיכוי להדבקה ב-HIV וקצב התפתחות המחלה תלויים, לפיכך, בפעילותה של מערכת החיסון באותה נקודת זמן ובמצב הבריאותי הכללי של האדם.
האלל הפגום נפוץ בעיקר בקרב אנשים לבנים, וכמעט ואינו קיים בגזעים אחרים. כ-10% מהלבנים בארצות הברית הם נשאים של המוטציה (הטרוזיגוטים), וכ-1% הם הומוזיגוטים (בסך-הכל כמיליון איש בארצות הברית).
גילוי המוטציה המקנה עמידות בפני איידס הביא לפיתוח תרופות בעלות רעיון דומה: הללו דומות לכימוקין הנקשר באופן שגרתי לקולטן CCR5; הן נקשרות אליו באופן קבוע וחוסמות אותו בפני הנגיף. לתרופות אלו הצלחה מסוימת, ובצידה חשש גדול: CCR5 אינו הקולטן היחיד אליו מסוגל הנגיף להיצמד; זן נדיר יחסית (שכיחות של 5% מכלל הזנים) של HIV נצמד לקולטן אחר, CXCR4. מיעוט של החולים שטופלו בתרופה חוסמת CCR5 חלו בכל זאת באיידס, לאחר שנדבקו בזן הנצמד לקולטן האחר. זן זה אלים יותר, וגורם להופעת תסמיני המחלה (ולמוות) בקצב מהיר. החשש הוא שדיכוי הזן השכיח של HIV יביא לשגשוג הזן האלים במרוצת הדורות. תופעה דומה גורמת לסלקציה של זני חיידקים עמידים לאחר חשיפה לסוגי אנטיביוטיקה שונים, וכן התרחשה במחלת המלריה בשנות ה-70; תרופות שהביאו להכחדת הזן השכיח והמתון של הפרוטיסט פלסמודיום, גורם המחלה, הביאו לחיזוקו של זן אלים יותר, הנפוץ כיום בעולם השלישי.
ב-2019 התגלה גן שאלל שלו מקנה עמידות לזן האיידס החודר דרך קולטן ה-CXCR4. מוטציה בגן TNPO3 מונעת את כניסת וירוס האיידס דרך קולטן ה-CXCR4.[דרוש מקור]
מקרי החלמה
[עריכת קוד מקור | עריכה]התיעוד הראשון של החלמה מלאה מאיידס נרשם ב-2007: טימותי ריי בראון, בן 44, אזרח ארצות הברית המתגורר בגרמניה. בראון חלה בלוקמיה, בנוסף לנגיף האיידס, ובמסגרת השתלת מח עצם שעבר כחלק מהטיפול בלוקמיה התברר שהושתל בו מח עצם שבגלל מוטציה גנטית היו חסרים בו קולטני ה-CCR5, קולטנים אשר באמצעותם חודר נגיף ה-HIV לתאים. לאחר שבראון החלים מהסרטן, נודע כי גופו התנקה לחלוטין גם מנגיף האיידס.
בשנת 2019 דווח על המקרה המתועד השני של החלמה מהנגיף:[4] אדם קסטילייחו, בן 40, במקור מוונצואלה וכעת מתגורר באנגליה, לקה בנגיף ה-HIV בשנת 2003. בשנת 2012 החל לקבל תרופות עבור הנגיף, ומאוחר יותר באותה השנה התגלתה אצלו לימפומת הודג'קין בדרגה 4. בשנת 2016 עבר קסטילייחו השתלת מח עצם מתורם שהסתבר שקיימת בגופו אותה מוטציה גנטית נדירה שמשפיעה על קולטני ה-CCR5, בדומה למקרה של בראון. הוא היה במעקב אצל צוות חוקרים מיוניברסיטי קולג' לונדון בהובלתו של פרופ' רווינדרה גופטה (אנ'), אשר חשפו את ממצאיהם ב-4 במרץ 2019 במגזין Nature ובכנס בסיאטל.[5] באותה תקופה הוא זוהה בתור "פציינט לונדון", עד אשר חשף את זהותו במרץ 2020.[6] במאמר הראשוני דווח על 18 חודשים ללא זיהוי הנגיף בגוף, ועם חשיפת זהותו התפרסם מאמר המשך במגזין the Lancet (אנ') אשר דיווח על 30 חודשים ללא זיהוי.[7] הדבר גרם לחוקרים להאמין כי קסטילייחו אכן החלים לחלוטין מהנגיף, שכן בספרות הרפואית הם נוטים להשתמש במונח "נסיגה" (אנ') מפני שהמחקר הרפואי אודות הנגיף מקשה על קביעת החלמה מוחלטת.
דרכי ההידבקות בנגיף
[עריכת קוד מקור | עריכה]נגיף ה-HIV מועבר באמצעות כניסתו לגוף האדם באחת מהדרכים הבאות, שהמשותף לכולן הוא מגע ישיר בין נוזלי הגוף. נגיף ה-HIV אינו עמיד במיוחד: מחוץ לגוף מסוגל הנגיף לשרוד במשך כ-20 דקות בלבד, והוא רגיש לחום ולכימיקלים שונים. עיקור פשוט באמצעות חימום או באמצעות חיטוי מביא להשמדה כמעט ודאית של הנגיף.
הנגיף אינו מועבר דרך אוויר, מזון, שתייה, או מגע פיזי רגיל. הנגיף אינו עובר במהלך נשיקות, מאחר שריכוז הנגיף ברוק נמוך ביותר, ויידרשו כמה ליטרים של רוק על-מנת לגרום להדבקה. עד היום לא נרשם מקרה של איידס שהועבר בנשיקה. המחלה אינה מועברת בעקיצת יתוש מכמה סיבות: כמות הנגיפים שיכולה להישאב בעקיצה נמוכה, הנגיפים מתים במערכת העיכול של היתוש והיתושים לא מחדירים דם לאדם הנעקץ אלא רוק בלבד.[8]
לאדם סיכוי גבוה יותר להדביק בשבועות הראשונים לאחר שנדבק. הסיכוי יורד מאוד בשלב הדגירה של הנגיף.
יחסי מין
[עריכת קוד מקור | עריכה]קיום יחסי מין עם נשא של הנגיף, ואגינליים, אנאליים ובמידה פחותה אוראליים, הוא הדרך הנפוצה להידבקות ב-HIV. הנגיף נמצא בכל הפרשות הגוף. באיברי המין (בשני המינים) ישנן נקבוביות סופגות מיקרוסקופיות, ולכן בקיום יחסי מין ואגינליים ללא קונדום, המונע מגע ישיר, יש סיכון להדבקה. גלולה למניעת היריון לא מספקת הגנה, וקוטלי זרע אף מגבירים את סיכויי ההדבקה בשל גירוי של הרירית. הסיכוי להדבקה במין אוראלי נמוך משמעותית, אך אפשרי. הסיכוי להדבקה במהלך מין אנאלי לא מוגן, גדול באופן יחסי, זאת בגלל קרעים מקרוסקופיים בפי הטבעת וברקטום הנגרמים במהלך החדירה, ומעלים את הסיכוי למגע בין נוזלי הגוף החודר, לנחדר.
כיום, במדינות המערב, יחסי מין לא מוגנים בין גברים מהווים אחוז ניכר ממקרי ההדבקה ב-HIV-1, בניגוד למתרחש במדינות מתפתחות שם רוב מקרי ההדבקה מתרחשים במהלך יחסי מין הטרוסקסואלים.
מאמצע שנות ה-90 קיימת עלייה בתופעת הברבק בקרב הומואים, תופעה בה מקיימים יחסי מין לא מוגנים במודע. בישראל מאז שנת 2005 חלה עלייה חריפה במספר מקרי ההדבקה של גברים צעירים שקיימו יחסי מין לא מוגנים עם גברים.[דרוש מקור]
הזרקת סמים
[עריכת קוד מקור | עריכה]דרך נפוצה נוספת להידבקות בנגיף היא שימוש בסמים בהזרקה. נוהג נפוץ במהלך ההזרקה הוא שאיבה של כמות קטנה של דם לתוך המזרק לפני ההזרקה, פעולה שמטרתה לקצר את תהליך ערבוב הסם בדם. כך נשארות שאריות מהנגיף בחוד המזרק, ובסביבה סגורה ולחה זו יכול הנגיף לשרוד זמן רב יחסית לעמידותו באוויר הפתוח (שהיא, כאמור, קטנה). האדם הבא שישתמש באותו מזרק, יזריק לגופו יחד עם הסם גם את הנגיף. מדינות שונות[דרושה הבהרה] החלו בסוף המאה ה-20 לחלק מזרקים בחינם וללא חשש להפללת המשתמשים בסמים, לאחר שהגיעו למסקנה שהתועלת מתרומתו של צעד זה למניעת ההדבקה בנגיף עולה על הנזק שבעידוד השימוש בסמים.
עירוי דם
[עריכת קוד מקור | עריכה]עירוי דם שמקורו בתרומת דם נגועה, שיינתן לאדם בריא יהפוך אותו בוודאות לנשא. רוב המדינות (ובהן ישראל) בודקות כיום כל תרומת דם מחשש להדבקה, ומבקשות מאנשים בקבוצת סיכון לנשאות HIV שלא לתרום דם מכיוון שהבדיקה אינה מזהה דם שנדבק לאחרונה בנגיף. אמצעים אלו נטרלו כמעט לחלוטין את הסיכון מהדבקות בנגיף HIV מעירוי דם ונכון לשנת 1998, הוערך כי בישראל ניתן עירוי דם נגוע בנגיף HIV אחת לכארבע שנים.[9] בשנות ה-80 (ובעיקר בשנים 1982 ו-1983), כשהמודעות למחלה וטכניקות זיהוי הנגיף היו בראשיתן, נדבקו חולים רבים מעירויי דם נגועים. חולי המופיליה סבלו מכך במיוחד, שכן הם נדרשים לעירויי דם תכופים. כיום מבוצע טיפול בחימום לגורם קרישה VIII, החומר החסר בדמם של רוב חולי ההמופיליה והניתן להם כחלק מהטיפול. החימום משמיד נגיפי HIV אפשריים אך אינו פוגע בגורם הקרישה. בנוסף ניתן כיום לייצר את גורם הקרישה באמצעים ביוטכנולוגיים בעזרת חיידקים. שיטה זו מחליפה בהדרגה את הצורך בעירויי דם לחולי המופיליה.
פצעים פתוחים
[עריכת קוד מקור | עריכה]כאשר שני פצעים מגיעים למגע פיזי ביניהם, קיימת סכנת הידבקות. סכנה זו קיימת בעיקר אצל צוותי הרפואה למיניהם, שמתגוננים מפניה בדרכים שונות ובהן שימוש בכפפות גומי.
מאם לתינוק
[עריכת קוד מקור | עריכה] ערך מורחב – הריון ו-HIV
ערך מורחב – הריון ו-HIV
קיים סיכוי של בין 15% ל-45% שאם נגועה ב-HIV תעביר את הנגיף לתינוקה. ההדבקה עשויה להתרחש בזמן ההריון, בזמן הלידה או לאחר הלידה - באמצעות הנקה. הסיכוי להדבקה פוחת בעשרות מונים אצל אמהות אשר נוטלות תרופות נגד איידס, אשר יולדות את תינוקן בניתוח קיסרי ואשר נמנעות מהנקה. בארצות העולם השלישי העברה מאם לתינוק היא מדרכי ההדבקה העיקריות, זאת בניגוד למדינות המפותחות. ועם זאת בהיעדר תחליפי חלב אם מספקים במדינות המתפתחות - ההמלצה היא בכל זאת להניק בשל הסיכון היותר גבוה לתינוק בהימנעות מהנקה.
מדי שנה נולדים בישראל כ-90 ילדים לאמהות החולות במחלה ומתוכם בין שמונה לתשעה תינוקות נדבקים בנגיף.[10]
אם נשאית HIV נכנסת להריון חשוב לדווח על כך למרפאת ה-HIV בה היא מטופלת. הדיווח חשוב משתי סיבות עיקריות:
- חלק מהתרופות נגד HIV עלולות לפגוע בעובר, ולכן יהיה צורך להתאים את תוכנית הטיפול התרופתי.
- ייתכן שיהיה צורך להוסיף טיפול תרופתי במטרה לצמצם את סיכויי הוולד להידבק ב-HIV. ללא טיפול קיים סיכון של 25% (אחד לארבע) שהעובר ידבק מהאם. עם טיפול יורד הסיכון לאחוז אחד בלבד (אחד ל-100).
לידה
[עריכת קוד מקור | עריכה]כדי להפחית את הסיכון להעברת הנגיף לתינוק ההמלצה בעבר לנשאיות HIV הייתה ללדת בניתוח קיסרי. כיום הגישה המקובלת לגבי נשים שאצלן הספירה הנגיפית נמוכה היא שלידה רגילה לא תגדיל את הסיכון להדבקה של התינוק. יש להיוועץ בנושא זה עם הצוות הרפואי במרפאת ה-HIV.
היריון כאשר אחד מבני הזוג נשא
[עריכת קוד מקור | עריכה]במקרה שאחד מבני הזוג נשא HIV ניתן להרות באופן בטוח באמצעות הפריה מלאכותית מבלי לסכן את בן הזוג הבריא בהדבקה בנגיף.
ראו גם יתומי איידס.
טיפול
[עריכת קוד מקור | עריכה]
נכון להיום (2022) איידס היא מחלה כרונית חשוכת מרפא, שאינה מוגדרת עוד כמחלה סופנית. הטיפול הניתן במחלה מצליח, ברוב המקרים, לדחות את התפרצות המחלה למשך שנים רבות. על פי הערכות משנת 2008 תוחלת החיים של נשא HIV המתחיל טיפול במחלה בגיל 20 הוא 69 שנים, כ-10 שנים פחות מתוחלת החיים של כלל האוכלוסייה. חולה איידס המתחיל את הטיפול במחלה רק לאחר התפרצות המחלה צפוי לתוחלת חיים כוללת של כ-60 שנה.[11] במחקר יותר עדכני נמצא שנשאי HIV גברים המגיבים היטב לטיפול ומצליחים לשמור את רמת ה-CD4 שלהם מעל 500 במשך מספר שנים מגיעים לתוחלת חיים כמעט רגילה. לעומת זאת, אצל נשים עדיין נמצא שיעור תמותה משמעותית יותר גבוה אצל נשאיות HIV מאשר אצל כלל האוכלוסייה.[12]
איידס היא מחלה נגיפית. מספר התרופות הקיימות נגד נגיפים אינו גדול, והטיפול במחלות נגיפיות מתמקד בעיקר במתן חיסונים - כלומר, עידוד מערכת החיסון להילחם בנגיף בעצמה. נגיף ה-HIV מציב אתגרים קשים בפני המדענים השוקדים על פיתוח תרופה למחלה. הקושי העיקרי הוא השתנותו המהירה של הנגיף. בכל הנגיפים חלות מוטציות, אך קצבן ב-HIV גבוה במיוחד. לַנגיף אין מנגנוני תיקון לחומר התורשתי, מנגנונים המצויים כמעט בכל היצורים החיים. מוטציות המתרחשות בו נשארות בעינן ומועברות לדור הבא של הנגיפים, אשר בתורו מייצר מוטציות חדשות. בנוסף, האנזים רוורס טרנסקריפטאז, אשר ממיר את ה-RNA של הנגיף ל-DNA, הוא מטבעו אנזים "רשלני", וגורם לשגיאות רבות ברצף הנוקלאוטידים, קרי: מוטציות. דרך פעולתם של הנוגדנים של מערכת החיסון, אשר תפקידם הוא לזהות ולהילחם במיקרואורגניזמים, מבוססת על זיהוי הפתוגן באמצעות גליקופרוטאינים (חלבונים בעלי שיירים סוכריים) המצויים על גבי הממברנה שלו. הגליקופרוטאינים שעל גבי HIV משתנים בקצב כה מהיר, כך שלמערכת החיסון אין סיכוי להתמודד עם הנגיף.
כיום קיימת שורה של תרופות אנטי-ויראליות הניתנות במקביל ותוקפות את נגיף ה-HIV מכמה כיוונים שונים ובכך גורמות לפחיתה משמעותית ביותר בעומס הנגיפי. ישנם מקרים שהנגיף אף מופחת לרמה שאין לזהותו (Undetectable). התרופות הצליחו להאריך בצורה ניכרת את הזמן שבין ההידבקות בנגיף ובין פריצת מחלת האיידס עצמה; מאז הוחל במתן השילוב של התרופות המכונה "קוקטייל" באמצע שנות התשעים נראה כי הוא מצליח למנוע את התפרצות המחלה אצל נשאים (אם הוא ניתן באופן רציף), כמו כן הצליחו התרופות להאריך את חייהם ולהטיב את איכות חייהם של חולי איידס, בהם המחלה התפרצה. בזכות הטיפולים החדשניים מוגדרת כיום המחלה ככרונית ולא כסופנית. התרופות נחלקות לשלושה סוגים:
- מעכבי רוורס טרנסקריפטאז. רוורס-טרנסקריפטאז הוא אנזים של הנגיף החיוני להתפתחותו בתאי הנשא. מעכבים של אנזים זה מונעים יצירת DNA מה-RNA של הנגיף, ובכך מונעים השתלבות הגנום הנגיפי בזה של התא הנגוע ושכפול הנגיף. AZT, התרופה הראשונה לאיידס שכבר אינה ניתנת כיום לחולי איידס, משתייכת לקטגוריה זו. התרופה (ששמה הכימי הוא 3'-אזידו-3'-דאוקסיתימידין) היא נגזרת של הנוקלאוטיד המכיל את הבסיס החנקני תימין (קבוצת הידרוקסיל אחת הוחלפה בקבוצת אזיד,N3). האנזים רוורס טרנסקריפטאז מזהה ומשתמש בטעות את הנוקלאוטיד המדומה בתהליך בניית ה-DNA, אך AZT אינו מתאים בצורה מושלמת לבניית הסליל, והתהליך מופסק. AZT נמכר בעבר תחת השמות המסחריים זידוֹבוּדין (Zidovudine), רטרוֹויר (Retrovir) ורטרוֹויס (Retrovis).
- AZT משתייך לקטגוריית NRTI (ראשי תיבות של Nucleotide Reverse Transcriptase Inhibitor, מעכבי רוורס טרנסקריפטאז נוקלאוטידיים). היות שגם תאי גוף החולה משתמשים בנוקלאוטידים לשם בניית ה-DNA שבהם, קיימת סכנה של פגיעה בתאי החולה, ואכן נטילת AZT ותרופות דומות במינון יתר עלולה לגרום נזקים חמורים. במעכבי רוורס טרנסקריפטאז שאינם נוקלאוטידים (NNRTI) לא קיימת בעיה זו, שכן תרופות אלו חוסמות את האתר הפעיל של האנזים ובכך מביאות להפסקת פעולתו. בשנים האחרונות אושרו תרופות חדשות ממשפחת רוורס טרנסקריפטאז כדוגמת אבקוויר שמוכיחות יעילות כנגד מרבית הזנים העמידים לתרופות מהדור הישן.
- מעכבי פרוטֵאַז. פרוטאז הוא אנזים של הנגיף החיוני להתפתחותו בתאי הנשא. מעכבים של אנזים זה מונעים חיתוך של מספר חלבונים נגיפיים, דבר המונע הרכבה של נגיפים חדשים בתוך התא הנפלש. רכיבי הנגיף מיוצרים בלימפוציט, אך אינם יכולים לחבור יחדיו ליצירת נגיף חדש. פרוטֵאַז (Protease) הוא שמה של קבוצת אנזימים אשר חותכים חלבונים. סאקווינאביר (Saquinavir) וריטונאוויר (Ritonavir) הם מעכבי הפרוטאז העיקריים.
- מעכבי חדירה מונעים מהנגיף לחדור אל תאי מערכת החיסון. זוהי קבוצת התרופות החדשה ביותר המבוססת על חלבונים קטנים המכונים פפטידים להבדיל ממולקולות קטנות במרבית התרופות. מסיבה זו הם לא נספגים היטב במערכת העיכול וניתנים בזריקה. כיום מאושר רק מעכב חדירה אחד לשימוש, אנפובירטיד (Enfuvirtide, שם מסחרי: פוזאון, Fuzeon). פוזאון מאושרת על ידי קופות החולים כמפלט אחרון, אך ורק לחולים אשר כל שאר התרופות כבר לא משפיעות עליהם. שתי סיבות עיקריות לכך: עלות התרופה (מעל ל-20,000 דולר לשנה לחולה) ואופן נטילתה (בהזרקה פעמיים ביום, נטל רב על החולים).
- מעכבי אינטגראז. אינטגראז הוא אנזים של הנגיף החיוני להתפתחותו בתאי הנשא. מעכבים של אנזים זה מונעים שילוב של החומר התורשתי של הנגיף בגנום התא הנפלש ובכך מונעים את המשך ההדבקה.
- חוסמי CCR5. קולטן ה-CCR5 מצוי על גבי לימפוציטים T-מסייע המהווים התא המאכסן של נגיף ה-HIV. הקולטן חיוני לחדירה של מרבית זני הנגיפים וחסימתו משבשת את חדירת הנגיף לתאים.

לרוב ניתנות לחולים שלוש תרופות משני הסוגים הראשונים יחדיו, וזאת כדי לשפר את יעילות הלחימה בנגיף ולהילחם בעמידות לתרופות, אותה מפתח הנגיף לאחר זמן מה. זהו כאמור אותו "קוקטייל" אותו נוטלים חולי איידס רבים. חולה המטופל בתרופות נגד איידס ואשר הנגיפים בגופו פיתחו עמידות בפני אחת התרופות, סביר להניח שבמקרה וידביק אדם אחר, יהיו הנגיפים בגופו של הנדבק עמידים אף הם לתרופה. את התרופות חשוב ליטול בעקביות לפי המינון המומלץ, שכן החסרה של אפילו מנה אחת עלולה לעודד את הנגיף לפתח עמידות.
כמה מהתרופות הניתנות כיום לחולי איידס מגלות יעילות עצומה במיגור הנגיף. ספירת הנגיף בדם לאחר שבועות ספורים של נטילת התרופה צונחת בצורה דרסטית, וספירת הלימפוציטים עולה. למרות זאת, לא צולח בידה של אף לא אחת מהתרופות להביא לריפוי מוחלט עקב הימצאותו של הנגיף בתאים ובקשרי לימפה אליהן אין לתרופה נגישות מספקת.
לרוב התרופות הניתנות לחולי איידס קיימות תופעות לוואי מתונות (בחילות, הקאות, סחרחורות, שלשול, צרבת) אשר לרוב חולפות לאחר תקופת הסתגלות בת חודשיים לערך.
במקביל לטכניקות ללחימה בנגיף, שוקדת האימונולוגיה על שני פתרונות נוספים:
- מציאת דרכים לחידוש מלאי תאי הדם הלבנים בגוף, ללא קשר להתפשטות הנגיף.
- הרכבת חיסון לאיידס. בשנים האחרונות נערכו ניסויים קליניים בקופים ובבני אדם, בהם הוזרקו נגיפי HIV מוחלשים אל הגוף. התוצאות אינן חד - משמעיות. נושא נוסף שנחקר הוא הימצאותם של נוגדנים ספציפיים כנגד איידס אצל חלק מהגברים שעשוי לסייע בפיתוח חיסון עתידי.[13]
ראו גם EuResist.
טיפול מונע לפני חשיפה
[עריכת קוד מקור | עריכה]'טיפול מונע לפני חשיפה' (PrEP) ניתן לקבוצות סיכון להידבקות בנגיף ה-HIV. הטיפול ניתן בצורת כדורים אשר נלקחים מדי יום. מרכזי בקרת המחלות ומניעתן מציינים כי "PrEP הוא כלי מונע עוצמתי ל-HIV וניתן לשלבו עם קונדומים ושיטות מניעה אחרות כדי לספק הגנה אפילו יותר גדולה מבשימוש בנפרד". בשנת 2021 אישר ה־FDA טיפול מונע הניתן בזריקה אחת לחודשיים.[14]
במרץ 2007 המליץ ארגון הבריאות העולמי לכלול מילה בין האמצעים להפחתת הסיכון להידבקות באיידס מיחסי מין הטרוסקסואליים, על סמך מחקרים המראים שהיא מפחיתה את שיעור ההידבקות של הנימולים בכ-60%.[15] ההמלצה מיושמת בעיקר בארצות בהן שיעור הנשאות גבוה (ראו ניתוחי מילה באפריקה שמדרום לסהרה).
טיפול מונע לאחר חשיפה
[עריכת קוד מקור | עריכה]'טיפול מונע לאחר חשיפה' (PEP - Post-exposure prophylaxis) מוצע לאנשי צוות רפואי שנחשפו לתוצרי דם חשודים, ולאנשים שקיימו יחסי מין לא מוגנים עם נשא, או אדם בקבוצת סיכון.
הטיפול ניתן במקרי חרום מאוד ייחודיים בהם קיים חשש סביר להדבקה ושיקול הדעת הוא של רופא זיהומולוג בלבד.
הטיפול עשוי למנוע הדבקה, אחרי חשיפה לנגיף ה-HIV, אם הוא ניתן בתוך מספר שעות. יעילות הטיפול יורדת במהירות ככל שעובר זמן ממועד החשיפה, ולאחר שבעים ושתיים שעות ממועד החשיפה הוא מאבד מיעילותו.[16]
הטיפול הוכח כיעיל בשמונים אחוז מהמקרים, בקרב אנשי צוות רפואי שנחשפו לנגיף, ומשערים שהוא יעיל גם לאחר חשיפה לנגיף במהלך קיום יחסי מין.
הטיפול המונע, נמשך כחודש, במהלכו מקבל המטופל את קוקטייל התרופות המוצע לנשאי איידס. הטיפול אינו קל ובמהלכו צפוי המטופל לחוות את תופעות הלוואי של הקוקטייל: חולשה חריפה, שילשול, כאב ראש, כאב גב, תחושת דיכאון, חרדה, ותחושת טעם מר בפה. בסמוך לקבלת הטיפול מומלץ להיעזר בשירות פסיכולוגי ותמיכה רגשית כמקובל ברוב מדינות אירופה וארצות הברית.
אין להסתמך על טיפול זה כתחליף ליחסי מין מוגנים.
מניעת התפשטות הנגיף
[עריכת קוד מקור | עריכה]נכון לשנת 2023, בהתאם להוראות ארגון הבריאות העולמי הדרך היעילה, הקלה והבטוחה ביותר למניעת הדבקה היא שימוש בקונדום.
עם התפשטות האיידס והבנתה בתחילת שנות ה-80 של המאה ה-20, נקטו שירותי הבריאות ברחבי העולם במאמצים למנוע את התפשטות המחלה. מאמצים אלו כוללים:
- בדיקת מנות דם לפני עירוי
- הוראות מחמירות לצוותים רפואיים כדי למנוע מעבר דם בין מטופלים
בנוסף, ננקטו צעדים הסברתיים ואחרים כדי לעודד את הציבור למנוע את הפצת המחלה. צעדים אלו כללו:
- הגברת המודעות לקיום ולסכנות המחלה על ידי פרסום חוצות, הסברה, יום האיידס העולמי ועוד
- עידוד השימוש בקונדומים
- עידוד גילוי האיידס בקרב הציבור, למשל על ידי מתן אפשרות לבדיקות אנונימיות בחינם
- חלוקת מזרקים חד פעמיים לצרכני סמים
- תהליך של מיסוד תעשיית המין ופיקוח ממשלתי עליה החל במדינות כגון אוסטרליה הולנד ונבדה ולפי מחקר אוסטרלי הוא בעל פוטנציאל להקטנת מספר הנדבקים ב-50%.[17]
חלק מצעדים אלו נתקלו בהתנגדות. גורמים שמרניים ודתיים התנגדו לפרסום המעודד שימוש בקונדומים ולצעדים הסברתיים המכירים ביחסים הומוסקסואליים. הייתה גם התנגדות לחלוקת מחטים בטענה שהיא עלולה להגביר את השימוש בסמים.
תומכי הצעדים הללו מביאים את אוסטרליה כדוגמה למדינה שהצליחה לצמצם את התפשטות האיידס הודות לאמצעים אלו, בניגוד לארצות הברית אשר לא פעלה מספיק בעזרת אמצעים אלו ובה האיידס התפשטה הרבה יותר.[18]
ב-26 בנובמבר 2008 פרסם ארגון הבריאות העולמי מחקר לפיו ניתן לצמצם את מקרי מחלת האיידס ב-95% תוך עשור על ידי בדיקות מוקדמות לגילוי הנגיף ונגישות לתרופות.[19]
ברזיל היא, כנראה, הדוגמה הבולטת ביותר למדינה מתפתחת שכנגד הערכות ותחזיות מצליחה לבלום את התפשטות הנגיף, וזאת הודות לתוכנית הפעולה הלאומית הייחודית שהיא הפעילה (ראו הרחבה בערך "איידס בברזיל"). גם המלחמה באיידס בתאילנד זוכה לחשיבות רבה מצד הממשלה המקומית ומביאה לתוצאות יעילות בצמצום התפשטות המחלה ובהורדת אחוזי התמותה של הנדבקים.
אישום פלילי על הפצת איידס
[עריכת קוד מקור | עריכה]בארצות הברית הועמדו לדין נשאי HIV שקיימו יחסי מין בלתי מוגנים באשמות כלליות כמו ניסיון לרצח או תקיפה. בנוסף, בכמחצית ממדינות ארצות הברית יש חוקים פליליים כנגד הפצת נגיף ה-HIV, בחלקן חוקים שחוקקו במיוחד כנגד מפיצי הנגיף.[20] חוקים אלו הם תוצאה של מדיניות פדרלית אשר דרשה ממדינות לחוקק חוק כנגד מפיצי איידס כתנאי לקבלת מימון לטיפול באיידס וחינוך מניעתי. אולם בשנת 2000 הדרישה בוטלה, ובשנת 2010 הוציא הממשל של ברק אובמה נייר עמדה הקורא לביטול החוקים הללו.[21] בישראל, סעיף 218 לחוק העונשין קובע: "העושה בהתרשלות מעשה העלול להפיץ מחלה שיש בה סכנת נפשות, דינו מאסר שלוש שנים, במזיד דינו מאסר שבע שנים" ובית המשפט העליון קבע כי איידס היא מחלה שיש בה סכנת נפשות.[22] בקנדה קבע בית המשפט העליון ב-1998 שקיום יחסי מין בלתי מוגנים על ידי נשא איידס ללא יידוע בן הזוג על המחלה היא רמאות הגורמת לכך שיחסי המין נחשבים תקיפה.[23]
במחקר שהשווה עמדות מרואיינים משיקגו שבאילינוי בה יש חוק ספציפי כנגד הפצת נגיף ה-HIV אל מול עמדות מרואיינים מניו יורק בה אין חוק ספציפי למניעת הפצת מחלות, נטען שלא נמצא שלחוק יש השפעה על התנהגות נשאי HIV.[24]
קיימת מחלוקת בציבור לגבי העמדה לדין של אנשים היודעים שהם נשאי HIV ומקיימים יחסי מין בלתי מוגנים. ישנם הטוענים שיש להגביל את האישום הפלילי רק למקרים שאדם בכוונה פועל להפצה של איידס. ארגון האו"ם לגבי איידס, UNAIDS, קורא למדינות להגביל את האישום הפלילי למקרים בהם אדם יודע שהוא נשא HIV, פעל מתוך כוונה להפיץ את המחלה ואכן הצליח בכך. מנגד, ישנם הטוענים שיש להעמיד לדין גם אנשים אשר היו בקבוצת סיכון ונמנעו מלהבדק ובעקבות זאת העבירו את המחלה לאדם אחר. יש הטוענים שאישום פלילי כנגד נשאי איידס יביא להימנעות של אנשים מלהבדק בעוד אחרים טוענים שלא סביר שאדם ימנע מלהבדק ובכך יסכן את חייו על ידי הימנעות מקבלת טיפול רק בגלל הרצון להפיץ את המחלה.[25] ישנם הטוענים שלא ניתן לפטור מאחריות את הנדבקים אשר היו צריכים לנקוט באמצעי זהירות כדי להימנע מהדבקות באיידס גם אם בן זוגם לא אמר להם שהוא נשא HIV. אחת הסיבות העיקריות שניתנה לאישום הפלילי הוא הרתעה, אולם ישנם הטוענים שהענישה אינה משיגה את מטרתה.[23]

כיום מקובלת הסברה שנגיף ה-HIV הוא וריאציה של מספר נגיפים דומים אשר תוקפים קופי אדם. בנקודה כלשהי בשנות ה-50 של המאה ה-20 נוצרה מוטציה בנגיף הקופי, שאפשרה לו להדביק בני אדם. ההדבקה הראשונה התרחשה באפריקה, לפי ההשערה המקובלת כתוצאה מציד או אכילת בשר קופים הנגועים בווירוס.[26][27][28] והמחלה התפשטה לאיטה ביבשת זו במשך עשרים השנים הבאות. ההדבקה הראשונה בעולם עליה ידוע בוודאות היא של אדם שמת ב-1959 ברפובליקה הדמוקרטית של קונגו. תמורות פוליטיות וחברתיות באפריקה של שנות ה-70, כולל נדידה גדולה של תושבים ממרכז אפריקה אל מזרחה, תרמו להפצת הנגיף.
ב-1977 מתה הרופאה הדנית גרטה ראסק (Grethe Rask), ובזמנו היא נחשבה האדם הלא-אפריקני הראשון אשר מת מאיידס. היא עבדה כרופאה במסגרת הצלב האדום ברפובליקה הדמוקרטית של קונגו בשנות ה-70, שם נדבקה בנגיף. בדיעבד התגלה הנגיף ברקמות שנלקחו מנער אמריקני שמת ב-1969, וכן ממלח נורווגי שמת ב-1976.
בשנת 1981 זוהתה לראשונה המחלה בארצות הברית - בתחילה לפי התסמינים שלה בלבד, ובראשם הדילול הקיצוני בספירת תאי הדם הלבנים. התאריך הרשמי לפרוץ המגפה במערב הוא ה-5 ביוני 1981. ביום זה דווח על חמישה צעירים הומוסקסואלים מלוס אנג'לס שלקו בדלקת ריאות הקשורה לאיידס (הם לקו בה במהלך מחצית השנה שקדמה לתאריך פרוץ המגפה). השם איידס ניתן למחלה רק בשנת 1982, לאחר שבמשך תקופה מסוימת היא נקראה GRID (קיצור של Gay-Related Immunodeficiency, "כשל חיסוני של הומוסקסואלים"). לא נדרש זמן רב עד שהמדענים הסיקו כי מרבית החולים אינם הומוסקסואלים כלל. מגפות מקומיות החלו בערים הגדולות של ארצות הברית, ובראשן ניו יורק וסן פרנסיסקו.[29] נגיף ה-HIV בודד לראשונה ב-1983.
מגפת האיידס היא פאנדמית (מגפה כלל-עולמית); נכון להיום, תחילת המאה ה-21, ברוב המוחלט של המדינות המגפה אינה מראה כל סימן של ירידה בתפוצתה. מעריכים כי נכון ל-2003 למעלה מ-40 מיליון אנשים ברחבי העולם נושאים את נגיף ה-HIV. כ-27 מיליון מתו עד כה ממחלות הקשורות לאיידס. במדינות העולם השלישי, ובעיקר באפריקה שמדרום לסהרה, מחלת האיידס היא מגפה של ממש, בעלת השלכות כלכליות וחברתיות מרחיקות לכת. שיעור החולים במחלה במדינות אלו מהווה כ-90% מכלל החולים בעולם. במדינות הנגועות ביותר - דרום אפריקה וזימבבואה, כשליש מהאוכלוסייה הבוגרת נושאת את הנגיף. מדינות אלו צפויות לאבד בשנים הקרובות דור שלם של תושבים. תוחלת החיים באפריקה שמדרום לסהרה נכון לשנת 2005 היא 47 שנים; מומחים מעריכים שללא מחלת האיידס הייתה תוחלת החיים עולה ל-67 שנים.
במדינות המערב קיימת יציבות יחסית במספר החולים. לאחר ירידה מסוימת במספר החולים באמצע שנות ה-90, חלה עלייה מחודשת בתחילת המאה ה-21. אחת הסברות היא שבקרב הציבור הצעיר התפתחה "עייפות איידס" מסוימת, כלומר: הפרסום האינטנסיבי בכל אמצעי התקשורת במערב בנוגע לדרכים למניעת איידס יצר דווקא אפקט שלילי וגרם להיאטמות ולחוסר רצון של הציבור לשמוע עוד ועוד; עם היאטמות זו באה גם הזנחה של אמצעי הזהירות.
יום האיידס העולמי חל בכל שנה ב-1 בדצמבר, והוא נועד להגברת המודעות למחלה בקרב הציבור. הרעיון לציון יום האיידס עלה בכנס שרי הבריאות העולמי ב-1988. במדינת ישראל הכריזו ארגוני האיידס על שבוע המודעות לאיידס שחל לראשונה ב-1998, עקב רמת הבורות הגבוהה כלפי המחלה, דרכי ההדבקה וההימנעות ממנה והיחס המפלה כלפי ציבור האנשים החיים עם הנגיף. יום הזיכרון העולמי לאיידס חל מדי שנה ב-21 במאי, והוא היום להזדהות עם עשרות מיליוני האנשים שנפטרו או שחיים עם הנגיף ברחבי העולם.
הנתונים שבטבלה שלהלן לקוחים מארגון הבריאות העולמי (WHO) ונכונים לשנת 2004. בצד ימין מוצגים אזורי העולם השונים, ובצד שמאל - מבחר מדינות (אין קשר בין שני צדי הטבלה). אחוז הנגועים ב-HIV ("אחוז" בטבלת המדינות) מתייחס לאנשים בגילאים 15 עד 49 בלבד; לעומת זאת, מקרי המוות מאיידס מתייחס לכלל האוכלוסייה.
| אזור | אחוז הנגועים ב-HIV באוכלוסייה הבוגרת |
מקרי מוות מאיידס בשנת 2004 |
מדינה | אחוז | מקרי מוות ב-2004 | |
| אפריקה שמדרום לסהרה | בין 6.9% ל-8.3% | בין 2.1 ל-2.6 מיליון | בוטסואנה | 37.3% | 33,000 | |
| האיים הקריביים | בין 1.5% ל-4.1% | בין 24 ל-61 אלף | זימבבואה | 24.6% | 170,000 | |
| אסיה | בין 0.3% ל-0.6% | בין 350 ל-810 אלף | דרום אפריקה | 21.5% | 370,000 | |
| מזרח אירופה ומרכז אסיה | בין 0.5% ל-1.2% | בין 39 ל-87 אלף | ארצות הברית | 0.6% | 14,000 | |
| אמריקה הלטינית | בין 0.5% ל-0.8% | בין 73 ל-120 אלף | ברזיל | 0.7% | 15,000 | |
| אוקיאניה | בין 0.1% ל-0.3% | פחות מ-1,700 | סוואזילנד | 38.8% | 17,000 | |
| המזרח התיכון וצפון אפריקה | בין 0.1% ל-0.7% | בין 12 ל-72 אלף | קניה | 6.7% | 150,000 | |
| צפון אמריקה ומערב אירופה | בין 0.3% ל-0.6% | בין 15 ל-32 אלף | ניגריה | 5.4% | 310,000 |
הטבלה שלהלן מציגה את ממדיה העולמיים של מגפת האיידס. הנתונים באותיות מוטות משוערים:
| שנה | מספר נשאים או חולים |
הדבקות חדשות |
מקרי מוות בשנה זו |
מקרי מוות עד כה |
| 1980 | 2,000,000 | לא ידוע | לא ידוע | לא ידוע |
| 1993 | 12,900,000 | לא ידוע | לא ידוע | 2,500,000 |
| 1999 | לא ידוע | 4,000,000 | לא ידוע | לא ידוע |
| 2000 | לא ידוע | 3,800,000 | לא ידוע | לא ידוע |
| 2001 | 34,900,000 | 3,400,000 | 2,500,000 | 20,000,000 |
| 2002 | 42,000,000 | 3,500,000 | 3,100,000 | 21,100,000 |
| 2003 | 37,800,000 | 4,800,000 | 2,900,000 | 24,000,000 |
| 2004 | 39,400,000 | 4,900,000 | 3,100,000 | 27,100,000 |
ארגון הבריאות האירופי הציג בשנת 2021 רשימת מדינות חלקית ואת דרגת הסיכון בהדבקה בנגיף. הציון מדורג בין 1 ל-5 (5 מוגדר כסכנה נרחבת וממשית להדבקה באותה מדינה והדירוג הנמוך מהווה סכנה פחותה.) ככל שהדירוג יורד מ-5 כך גם יורדת באותה מדינה סכנת ההדבקה. מדינות שאינן מוצגות בתרשים סירבו בשיתוף המידע הרפואי והקליני שלהן כלפי ארגון הבריאות האירופי. ארגון הבריאות האירופי המליץ על שימוש בקונדום בכל המדינות ללא כל קשר לדירוג ואף במדינות עם סכנת הדבקה ממשית לא היסס להוסיף הערת אזהרה על הימנעות מיחסי מין באותה המדינה.
מידע זה נכון לשנת 2023
 אוסטריה 3
אוסטריה 3 אוסטרליה 3
אוסטרליה 3 אוקראינה 3
אוקראינה 3 איחוד האמירויות הערביות 4
איחוד האמירויות הערביות 4 איטליה 5
איטליה 5 איי שלמה 1
איי שלמה 1 איסלנד 1
איסלנד 1 איראן 1
איראן 1 אירלנד 3
אירלנד 3 אלג'יר 3
אלג'יר 3 אלבניה 2
אלבניה 2 אנגליה 4
אנגליה 4 ארגנטינה 4
ארגנטינה 4 ארצות הברית 5
ארצות הברית 5 בולגריה 3
בולגריה 3 בוליביה 4
בוליביה 4 בלגיה 4
בלגיה 4 בחריין 3
בחריין 3 ברזיל 5
ברזיל 5 גרינלנד 1
גרינלנד 1 גרמניה 4
גרמניה 4 דנמרק 3
דנמרק 3 דרום אפריקה 5
דרום אפריקה 5 הודו 5
הודו 5 הולנד 4
הולנד 4 הונגריה 3
הונגריה 3 טורקיה 4
טורקיה 4 יוון 4
יוון 4 יפן 3
יפן 3 ירדן 2
ירדן 2 ישראל 5
ישראל 5 לבנון 1
לבנון 1 לוב 1
לוב 1 לוקסמבורג 2
לוקסמבורג 2 מונקו 2
מונקו 2 מלזיה 4
מלזיה 4 מצרים 4
מצרים 4 מקסיקו 4
מקסיקו 4 מרוקו 3
מרוקו 3 נורווגיה 4
נורווגיה 4 ניו זילנד 3
ניו זילנד 3 סוריה 1
סוריה 1 הרפובליקה העממית של סין 4
הרפובליקה העממית של סין 4 סינגפור 3
סינגפור 3 ספרד 5
ספרד 5 סרביה 2
סרביה 2 עומאן 2
עומאן 2 עיראק 1
עיראק 1 ערב הסעודית 3
ערב הסעודית 3 פולין 2
פולין 2 פורטוגל 5
פורטוגל 5 פיג'י 1
פיג'י 1 פינלנד 2
פינלנד 2 הפיליפינים 3
הפיליפינים 3 צ'כיה 4
צ'כיה 4 צרפת 4
צרפת 4 קולומביה 5
קולומביה 5 קובה 4
קובה 4 קנדה 5
קנדה 5 קפריסין 3
קפריסין 3 קרואטיה 2
קרואטיה 2 רומניה 4
רומניה 4 רוסיה 5
רוסיה 5 שוודיה 3
שוודיה 3 שווייץ 3
שווייץ 3 תאילנד 5
תאילנד 5
תפוצת נגיף HIV בישראל
[עריכת קוד מקור | עריכה] ערך מורחב – איידס בישראל
ערך מורחב – איידס בישראל
בנובמבר 2009 העריכה המחלקה לשחפת ואיידס במשרד הבריאות הישראלי כי במדינת ישראל חיים כששת אלפים ושלוש מאות נשאים של נגיף HIV.[30] על פי הזיהוי בבדיקות של 4,525 נשאים (כולל כ-450 חולים) וההערכה שיש עוד 1,800 נשאים שטרם זוהו ככאלו. עוד 1,226 נשאים וחולים מתו או עזבו את ישראל.[30]
בדיקת HIV
[עריכת קוד מקור | עריכה]
זיהוי מוקדם של הנגיף מאפשר טיפול מציל חיים, ומונע הדבקה של אחרים. בישראל כמו ברוב מדינות המערב, ניתן כיום לבצע בדיקות איידס, בחינם ובעילום שם.
הבדיקה המרכזית המבוצעת בישראל כיום היא בדיקת הקומבו, אשר עם פיתוחה והתקדמותה, מסוגלת לזהות את הנגיף במהירות ועם תקופת חלון של שבועיים עד שלושה בלבד. לצידה קיימות שתי בדיקות נוספות, אשר כיום פחות רלוונטיות.
בדיקת קומבו
[עריכת קוד מקור | עריכה]בדיקת הקומבו (HIV Ag/Ab Combo), משלבת בין בדיקה לאיתור הנגיף עצמו, על ידי זיהוי אנטיגן p24, ובדיקת ELISA רגילה. אנטיגן זה עולה בגוף במהירות בשבוע הראשון להדבקה ומגיע לרמת זיהוי כבר בשבוע השני. לאחר כחודש אנטיגן זה יורד בהדרגה עקב יצירת נוגדנים בגוף. לפיכך, בדיקת הקומבו החדשה והמשולבת, יכולה לספק תשובה החל משבועיים אחרי חשיפה אפשרית לנגיף, עת שאנטיגן הנגיף ברמת זיהוי של הבדיקה. למרות זאת, ליתר ביטחון, ההנחיות של משרד הבריאות הן להיבדק בבדיקה כעבור 21 ימים.
הבדיקה מבוצעת כיום בכל מרפאות האיידס בבתי החולים וכן בוועד למלחמה באיידס.
בדיקת ELISA
[עריכת קוד מקור | עריכה]בדיקת ELISA היא בדיקה שבעבר הייתה הנפוצה ביותר, עד להתקדמות הקומבו. היא מאתרת נוגדנים בדם הספציפיים לנגיף ה-HIV. נוגדנים מיוצרים על ידי לימפוציטים מסוג B והללו אינם נפגעים בשלבי המחלה הראשונים. מרגע חדירת הנגיף לגוף ועד להופעת כמות ניתנת לזיהוי של נוגדנים בדם עוברים לפחות חודשיים; לפיכך יש להמתין חודשיים בין רגע הידבקות פוטנציאלי (קיום יחסי מין, למשל) ובין הבדיקה. בכאחוז אחד של החולים נדרשת תקופת המתנה ארוכה אף יותר (אך לא יותר מחצי שנה). הבדיקה עצמה היא בדיקת דם רגילה, והתוצאות ניתנות תוך ימים ספורים מרגע הבדיקה. תוצאה שלילית (כלומר - היעדר נוגדנים והיעדר הנגיף) אמינה כמעט ב-100% מהמקרים. לתוצאה חיובית, לעומת זאת, אמינות פחותה, ויש לבצע בדיקה נוספת על מנת לאשש או להפריך אותה. במקרים מסוימים תיתן הבדיקה תוצאה גבולית, העשויה לרמוז על הדבקה בתוך פחות מחודשיים. גם במקרה זה יש לבצע בדיקה נוספת. הבדיקה זמינה בכל המרכזים הרפואיים, ובקופות החולים ללא תשלום. בחלק מהמרכזים הרפואיים ובוועד למלחמה באיידס והמרפאה הפתוחה בירושלים, ניתן לעשות בדיקה זו באנונימיות. במקרים נדירים של שיבוש במערכת ייצור הנוגדנים של הגוף, כמו בתסמונות XLA ו-CVID, לא יהיה תוקף לבדיקת הנוגדנים השגרתית לנגיף ה-HIV, ונשא יקבל תוצאה זהה לזו של אדם בריא.
בדיקת מהירה
[עריכת קוד מקור | עריכה]בדיקת דם לגילוי HIV, הנותנת תוצאה בתוך כחצי שעה. מידת הדיוק של הבדיקה דומה לבדיקת ה-ELISA, אך חלון הזמנים מרגע החשיפה ועד להופעת תוצאה חיובית, גדול בחודש, והיא אינה נותנת תוצאות גבוליות, בתוך חלון הזמנים. הבדיקה תלווה בדרך כלל בבדיקת ELISA, שתוצאתה תינתן לאחר מספר ימים. בדיקה זו נעשית בדרך כלל בתשלום.
בדיקת תספיג חלבון
[עריכת קוד מקור | עריכה]בדיקת תספיג חלבון (Western blot), היא הבדיקה המדויקת והיקרה ביותר. היא משמשת כבדיקת אימות, המכריעה האם הנבדק הוא נשא, לאחר שהתקבלו תוצאות גבוליות או חיוביות בבדיקות מוקדמות. זו שיטה ביוכימית הקרובה לתספיג דנ"א. בדיקת תספיג חלבון נערכת על ידי משרד הבריאות, ולא ניתן לעשותה בעילום שם.
בדיקת PCR
[עריכת קוד מקור | עריכה]בדיקה ישירה לגילוי הנגיף מבוצעת באמצעות PCR, וניתן לבצעה כבר לאחר שבועיים מרגע החשד להדבקה. בדיקה מזהה את הנגיף ישירות, ולא את הנוגדנים. בדיקה זו יקרה ומסובכת והיא אינה משמשת כבדיקה לגילוי אלא כבדיקה לנשאים שאומתו על מנת לעקוב אחר העומס הנגיפי (כמות הנגיפים במיליליטר דם) שלהם ולפיכך לקבוע את יעילות הטיפול בהם.
השערות חלופיות בנוגע לתסמונת האיידס
[עריכת קוד מקור | עריכה] ערך מורחב – הכחשת איידס
ערך מורחב – הכחשת איידס
לצד הדעה הרווחת בנוגע לנגיף הגורם לתסמונת האיידס ולמקורו, הועלו שלל תאוריות אלטרנטיביות המציעות הסברים אחרים. חלקן של התאוריות זוכות לתמיכה מסוימת, גם בקרב חוגים מדעיים נחשבים; אחרות גובלות ב"תאוריות קונספירציה". רובה המוחלט של הקהילה המדעית דוחה את התאוריות הללו בכל פה ומאשים את מפיציהן בהתעלמות מעובדות מדעיות, בעריכת ניסויים מפוקפקים, בפרשנות תמוהה ומסלפת לתוצאות ולתצפיות מדעיות ובהטעייה חמורה ובלתי-אחראית של הציבור. להלן מספר תאוריות אלטרנטיביות:
- תסמונת האיידס אינה נגרמת כתוצאה מנגיף. ממציא התאוריה ומסבירה הראשי הוא פרופסור פיטר דוסברג (Peter Duesberg), אשר נולד ולמד בגרמניה ומלמד כיום באוניברסיטת קליפורניה בברקלי. דואיסברג טוען כי אין הוכחה ממשית שנגיף כלשהו גורם לאיידס. לטענתו, בחולים בתסמונת איידס רבים לא נתגלה הנגיף; אנשים רבים הנושאים את הנגיף אינם חולים באיידס. הגורם לאיידס לדעת דואיסברג הם סמים למיניהם. גם AZT, התרופה העיקרית המשמשת כיום לטיפול באיידס, מעודדת, לטענתו, את המחלה ובהחלט אינה מדכאת אותה.
מדען אחר אשר תומך בהשערה זאת הוא קארי מוליס, אשר זכה ב-1993 בפרס נובל לכימיה עבור המצאת ה-PCR. מוליס, אשר תומך בכמה תאוריות אחרות שלא מקובלות במדע, אף כתב הקדמה לספרה של מכחישת האיידס קריסטין מג'ורה (Christine Maggiore). מג'ורה ובתה הצעירה מתו שתיהן מאיידס, לאחר שלא קיבלו טיפול במחלה.
אדם נוסף שהתפרסם כתומך בתאוריה הוא תאבו מבקי, נשיא דרום אפריקה בשנים 1999–2008. מבקי סירב בעבר להתיר משלוחי תרופות נגד איידס לארצו (שבה, נכון ל-2008, למעלה מ-15% מהאוכלוסייה נגועה ב-HIV[31]), בטענה שתאגידי התרופות המערביים משתמשים בתושבי אפריקה כבשפני ניסיונות עבור תרופותיהם המפוקפקות. מבקי הרחיב את התאוריה של דואיסברג וטען כי עוני, תזונה לקויה וזיהומים כרוניים גורמים לאיידס. שרת הבריאות של מבקי, מנטו צ'באללה מיסמנג, ניסתה לטפל במגפת האיידס בעזרת ירקות, כמו סלק ושום. מבקי מנע בתחילה באופן גורף את שיווקן של כל התרופות נגד איידס, אך לאחר מחאות חריפות בארצו הוקלו ההגבלות על ייבוא התרופות. בשנת 2002 הכיר הפרלמנט הדרום אפריקני באופן רשמי בנגיף ה-HIV כגורם לתסמונת האיידס.
- נגיף ה-HIV פותח על ידי בני אדם. התאוריה טוענת שנגיף האיידס פותח במעבדות ממשלתיות או צבאיות למיניהן; בדרך-כלל ננקב שמה של ארצות הברית בהקשר זה. חלק מהתאוריות טוענות שהפיתוח היה מכוון, למטרת לוחמה ביולוגית; תאוריות אחרות טוענות כי מדובר בתאונה. הביולוג הגרמני יקוב זגל טוען כי הצבא האמריקני יצר את נגיף האיידס ב-1977, וניסה אותו על אסירים תמורת שחרורם המוקדם. לאחר שהאסירים שוחררו הם הפיצו את הנגיף בקרב האוכלוסייה. אחת התומכות בתאוריה הכללית שנגיף האיידס יוצר באופן מלאכותי היא הביולוגית, הפוליטיקאית והפעילה הסביבתית ואנגרי מאטאיי מקניה, זוכת פרס נובל לשלום בשנת 2004.

- מיגור מחלות באפריקה גרם להתפרצות האיידס. ב-1979 מוגרה מכדור הארץ מחלת האבעבועות השחורות, זאת על ידי מבצע חיסון מקיף של ארגון הבריאות העולמי; זהו בדיוק הזמן בו הופיעו מקרי האיידס הראשונים, ולדעת רבים אין מדובר בצירוף מקרים. תומכי התאוריה טוענים כי נגיף האבעבועות המוחלש מסייע לנגיף ה-HIV לתקוף את הלימפוציטים ולגרום לאיידס. עניין רב הוסב לתאוריה זו לאחר שמגלה נגיף ה-HIV, רוברט גאלו, הכריז כי הסבירות שמדובר בצירוף מקרים נמוכה, ושעל אף שאין ספק שנגיף ה-HIV גורם לאיידס, הרי שסביר כי גורמים נוספים מוכרחים להיות בגופו של אדם כדי שהאיידס יופיע אצלו[דרוש מקור].
- תאוריה דומה מתמקדת בחיסונים כנגד שיתוק ילדים (פוליו), אשר ניתנו לכמיליון תושבים אפריקניים בין השנים 1957 ו-1960. החיסון הוכן באמצעות גידול נגיף הפוליו המוחלש על-גבי רקמות שנלקחו מכליות של קופי שימפנזה. רקמות אלו, לטענת התומכים בתאוריה, היו נגועות ב-HIV. תחרות בין מעבדות בארצות הברית הביאה לעבודה רשלנית של אחת מהן, אשר לא השכילה לזהות את הנגיף. בדיקות גנטיות שנעשו לחיסונים האלה הוכיחו מעל לכל ספק כי החיסונים לא הוכנו משימפנזים ולכן לא הכילו SIV או HIV.[32]
- בדומה לתאוריה שלעיל ("נגיף האיידס פותח על ידי בני אדם"), גם כאן נחלקות הדעות בין תאונה ומזימה. תאוריות הקונספירציה הקיצוניות ביותר טוענות כי חיסוני הפוליו והאבעבועות הודבקו במתכוון ב-HIV על ידי ארגון הבריאות העולמי וממשלות המערב, זאת במטרה למגר אוכלוסיות מסוימות בעולם - בעיקר שחורים ואסייתים.
אישים ידועים שנפגעו או מתו מאיידס או חיים באופן מוצהר עם נגיף ה-HIV
[עריכת קוד מקור | עריכה]
רבים סבורים כי מודעות רצינית לנגיף ה-HIV הופיעה בציבור רק לאחר שכמה אישים ידועים נפטרו מאיידס. אישים ידועים רבים אשר נדבקו ב-HIV נרתמו למאבק ולהגברת המודעות אליו. להלן רשימה מצומצמת:
- מישל פוקו – פילוסוף צרפתי (נפטר ב-1984).
- ג'ון הולמס – שחקן פורנוגרפיה (נפטר ב-1988)
- רוק הדסון – שחקן קולנוע אמריקאי (אחד האישים הידועים הראשונים שנפטרו מאיידס ב-1985).
- רוי כהן – משפטן אמריקאי ממוצא יהודי (נפטר ב-1986).
- ג'יה קרנג'י – דוגמנית אמריקאית נחשבה לדוגמנית העל הראשונה. (נפטרה ב-1986).
- ליברצ'ה – פסנתרן ושחקן אמריקאי (נפטר ב-1987).
- רוברט מייפלת'ורפ – צלם אמריקאי (נפטר ב-1989).
- קית' הרינג – צייר אמריקאי (נפטר ב-1990).
- פרדי מרקיורי – מוזיקאי בריטי סולן להקת קווין (נפטר ב-1991).
- לאונרד פריי – שחקן קולנוע אמריקאי מועמד פרס אוסקר (כוכב "כנר על הגג") (נפטר ב-1988).
- בראד דייוויס – שחקן קולנוע אמריקאי (כוכב "אקספרס של חצות") (נפטר ב-1991).
- אייזק אסימוב – סופר מדע בדיוני (נדבק מעירוי דם נגוע בעת שעבר ניתוח בלבו, נפטר ב-1992).
- אנתוני פרקינס – שחקן קולנוע אמריקאי (נפטר ב-1992).
- ארתור אש – טניסאי אמריקאי (נפטר ב-1993).
- עמוס גוטמן – במאי קולנוע ישראלי (נפטר ב-1993).
- רודולף נורייב – רקדן רוסי (נפטר ב-1993).
- Eazy- E – ראפר אמריקאי (נפטר ב-1995).
- יוני חן – שחקן קולנוע ומדבב ישראלי (נפטר ב-1995).
- עפרה חזה – זמרת ישראלית (נפטרה ב-2000).
- מג'יק ג'ונסון – כדורסלן אמריקאי, הודיע על היותו נשא HIV ב-1991, פרש מליגת ה-NBA ומקדיש מאז את חייו להסברה. מאז ועד היום לא הופיעו אצלו תסמיני איידס.
- ג'י וואלס – מדליסט אולימפי אוסטרלי, הומוסקסואל מוצהר, הודיע על היותו נשא HIV באוגוסט 2012 בריאיון לעיתון "סטאר אובסרבר".
- צ'ארלי שין – שחקן הוליוודי מפורסם, הודיע על היותו נשא HIV בנובמבר 2015 בריאיון לתוכנית הבוקר של רשת NBC.
- קונצ'יטה וורסט – זמרת אוסטרית זוכת אירוויזיון 2014.
לקריאה נוספת
[עריכת קוד מקור | עריכה]- הואנג, א' (2002). מגפת האיידס עברה את שנתה העשרים. בתוך: סימני חיים-המגמות המעצבות את חיינו. מרכז השל, 2002. עמ' 92–93.
- הלוויל, ב' (2000). מגפת ה-AIDS פוגעת במיוחד באפריקה. בתוך: סימני חיים 2000. מכון ירושלים לחקר ישראל, מרכז השל לקיימות. עמ' 96–97.
- ברנר, ש' (1993). מחלות מין. דיונון.
קישורים חיצוניים
[עריכת קוד מקור | עריכה]בעברית:
- הערך "איידס", באתר ויקירפואה
- אברהם מורג, רקע מדעי על איידס - המאמר המקיף הראשון בעברית על המחלה (ראה אור במקור במקור: אסיא מה-מו (יב, א-ב), טבת תשמ"ט, עמ' 5–27)
- איידס, באתר משרד הבריאות
- איידס - המדריך המלא, באתר כללית
- הוועד למלחמה באיידס
- איידס - באתר School4u
- ד"ר איציק לוי, 10 מיתוסים על איידס שהגיע הזמן לנפץ, באתר ynet, 2 בדצמבר 2007
- ארז גרטי, מחלת האיידס והדרכים להילחם בה, במדור "מאגר המדע" באתר של מכון דוידסון לחינוך מדעי, 2 ספטמבר 2009
- נעם לויתן, תחילתה של מגפת האיידס, באתר של מכון דוידסון לחינוך מדעי, 5 ביוני 2021
- מדוע הטיפול באפריקה נכשל, הוועד למלחמה באיידס, BBC
- עדי שורץ, איידס: תוחלת חיי החולים עלתה, אבל אין חיסון באופק, באתר הארץ, 5 בדצמבר 2008
- איידס (תסמונת הכשל החיסוני הנרכש), באתר כל זכות
 הילו גלזר, נגועים: תולדות האיידס בישראל, באתר הארץ, 26 בנובמבר 2015
הילו גלזר, נגועים: תולדות האיידס בישראל, באתר הארץ, 26 בנובמבר 2015- דוד גורביץ' ודן ערב, הערך "איידס", באתר אנציקלופדיה של הרעיונות
- בפעם השנייה בהיסטוריה: אדם נרפא מאיידס, באתר וואלה, 5 במרץ 2019
באנגלית:
- יום האיידס העולמי
- סוכנות האו"ם למאבק באיידס
- איידס, באתר אנציקלופדיה בריטניקה (באנגלית)
 אידס (מחלה), דף שער בספרייה הלאומית
אידס (מחלה), דף שער בספרייה הלאומית
הערות שוליים
[עריכת קוד מקור | עריכה]- ^ בית המשפט העליון: איידס לא שווה מוות, באתר הוועד למלחמה באיידס
- ^ MedPage Today, HIV Life Expectancy Approaching Normal
- ^ PLOS ONE: Iron Status Predicts Treatment Failure and Mortality in Tuberculosis Patients: A Prospective Cohort Study from Dar es Salaam, Tanzania
- ^ Mandavilli, Apoorva (2019-03-04). "H.I.V. Is Reported Cured in a Second Patient, a Milestone in the Global AIDS Epidemic". The New York Times (באנגלית אמריקאית). ISSN 0362-4331. נבדק ב-2020-05-01.
- ^ Ravindra K. Gupta, Sultan Abdul-Jawad, Laura E. McCoy, Hoi Ping Mok, HIV-1 remission following CCR5Δ32/Δ32 haematopoietic stem-cell transplantation, Nature 568, 2019-04, עמ' 244–248 doi: 10.1038/s41586-019-1027-4
- ^ Mandavilli, Apoorva (2020-03-09). "The 'London Patient,' Cured of H.I.V., Reveals His Identity". The New York Times (באנגלית אמריקאית). ISSN 0362-4331. נבדק ב-2020-05-01.
- ^ Ravindra Kumar Gupta, Dimitra Peppa, Alison L. Hill, Cristina Gálvez, Evidence for HIV-1 cure after CCR5Δ32/Δ32 allogeneic haemopoietic stem-cell transplantation 30 months post analytical treatment interruption: a case report, The Lancet HIV 0, 2020-03-10 doi: 10.1016/S2352-3018(20)30069-2
- ^ למה יתושים לא מעבירים איידס
- ^ Edward H. Kaplan, Israel’s ban on use of Ethiopians’ blood: how many infectious donations were prevented?, Lancet. 1998 Apr 11;351(9109):1127-8. PMID 9660600
- ^ הריון ואיידס, באתר מכבי שירותי בריאות
- ^ Life Expectancy With HIV Increases Dramatically, July 28, 2008, AIDSMED
- ^ Tim Horn, Normal Life Expectancy With Maintenance of CD4s Above 500, March 2, 2010, AIDSMEDS
- ^ חיסון טבעי לאיידס אצל גברים הטרוסקסואליים
- ^ ד, פריצת דרך במאבק ב-HIV: אושרה זריקה למניעת הדבקה שניתנת אחת לחודשיים, באתר ynet, 21 בדצמבר 2021
- ^ News releases 2007 WHO and UNAIDS announce recommendations from expert consultation on male circumcision for HIV prevention, באתר ארגון הבריאות העולמי, 28 במרץ 2007
- ^ "מהו ה-PEP?" באתר הוועד למלחמה באיידס
- ^ Eleanor Goldberg, Legalizing Prostitution Could Reduce HIV Infections Nearly In Half, HuffPost, 2014-07-25 (באנגלית)
- ^ Bill Bowtell, Applying the Paradox of Prevention: Eradicate HIV, August 4, 2008
- ^ שלמה שמיר, מחקר: ניתן לצמצם האיידס ב-95% תוך 10 שנים, באתר הארץ, 26 בנובמבר 2008
- ^ David, Lori A., The Legal Ramifications in Criminal Law of Knowingly Transmitting AIDS, 19 Law & Psychol. Rev. 259 (1995)
- ^ Lynda Waddington, White House report: End state criminalization of HIV transmission, July 20, 2010, Iowa Independent
- ^ ע"פ 11699/05 סרפו נ' מדינת ישראל, ניתן ב־23 ביוני 2008
- ^ 1 2 Anne Merminod, The Deterrance Rational in the criminalization of HIV/AIDS, Lex Electronica, winter 2009
- ^ Do Criminal Laws Influence HIV Risk Behavior? An Empirical Trial
- ^ Philip B. Berger, Prosecuting for knowingly transmitting HIV is warranted, CMAJ. 2009 June 23; 180(13): 1368
- ^ Paul M. Sharp and Beatrice H. Hahn, Origins of HIV and the AIDS Pandemic, Science, 1.9.2011
- ^ ,AIDS – AIDS as a zoonosis: scientific and public health implications Science, February 2000 https://www.researchgate.net/publication/12664725_AIDS_-_AIDS_as_a_zoonosis_scientific_and_public_health_implications
- ^ Risk to human health from a plethora of simian immunodeficiency viruses in primate bushmeat, https://www.researchgate.net/publication/12664725_AIDS_-_AIDS_as_a_zoonosis_scientific_and_public_health_implications
- ^ וושינגטון פוסט, 200 נפטרו ממחלה מסתורית בארה"ב, מעריב, 9 באוגוסט 1982
- ^ 1 2 ד"ר דניאל שם טוב (עורך), HIV/איידס בישראל, דו"ח אפידמיולוגי תקופתי 1981-2008, המחלקה לשחפת ואיידס במשרד הבריאות, ירושלים, נובמבר 2009
- ^ HIV and AIDS in South Africa, Avert, 2015-07-21 (באנגלית)
- ^ Forensic epidemiology. Vaccine theory of AIDS origin... [Science. 2000] - PubMed - NCBI
הבהרה: המידע בוויקיפדיה נועד להעשרה בלבד ואינו מהווה ייעוץ רפואי.
