סרפין

מעכבי סרין פרוטאזות או סרפינים (מאנגלית: Serpins; Serine protease inhibitors), קבוצת חלבונים בעלי מבנה דומה אשר זוהו לראשונה כמערך של חלבונים אשר מסוגלים לעכב פרוטאזות (אנזימים המפרקים חלבונים).
החלבונים הראשונים מקבוצה זו שנחקרו בצורה נרחבת היו שני חלבונים שמקורם מפלזמת הדם באדם: אנטיתרומבין, אשר מבקר את קרישת הדם, ואנטיטריפסין, שלו תפקיד במניעת דלקות. בתחילה התרכז המחקר בתפקידם של אלו במחלות באדם: מחסור באנטיתרומבין עלול לגרום לפקיק (תרומבוס), בעוד שמחסור באנטיטריפסין עלול לגרור נפחת. בשנת 1980 הנט ודייהוף (Hunt & Dayhoff) גילו את התגלית המפתיעה כי מולקולות אלו בעלות רצף חומצות אמינו דומה לזה של החלבון העיקרי בחלבון הביצה, אובלבומין. הם שיערו כי מדובר בקבוצה חדשה של חלבונים.[1] עד היום זוהו למעלה מאלף מעכבי סרין פרוטאזות, מהם 36 חלבונים אנושיים, וכן חלבונים שמקורם מצמחים, מחיידקים, מחיידקים קדומים ומנגיפים מסוימים. מעכבי סרין פרוטאזות מהווים אפוא את המשפחה הגדולה והמגוונת ביותר של מעכבי פרוטאזות.
מרבית הסרפינים מבקרים תהליכי פירוק של חלבונים. עם זאת ישנם גם סרפינים שאינם מעכבים אנזימים, אלא מקיימים מגוון תפקידים אחרים, כגון אחסון (אובלבומין בחלבון הביצה), נשאים של הורמונים (גלובולין קושר תירוקסין, גלובולין קושר קורטיזול) וגנים מדכאי סרטן (מספין). המונח serpin משמש גם לתיאורם של האחרונים, הגם שאין הם מעכבים.[2]
מאחר שמעכבי סרין פרוטאזות אחראיים על בקרת תהליכים חשובים כקרישת דם ודלקות, חלבונים אלו הם מושא למחקר רפואי. חלבונים אלו הם גם מקור לעניין עבור חוקרי ביולוגיה מבנית וחוקרי קיפול חלבונים, מאחר שהם עוברים שינוי ייחודי ודרמטי במבנה (שינוי קונפורמציה), כאשר הם מעכבים את פרוטאזות המטרה. תופעה זו מיוחדת במינה, וזאת משום שמרבית מעכבי הפרוטאזות פועלים פשוט כמולקולות "מנעול ומפתח" אשר נקשרות לפרוטאז וחוסמות את הגישה לאתר הפעיל בו (למשל אפרוטינין). למנגנון של מעכבי סרין פרוטאזות יש מעלות מסוימות, אך גם מספר מגרעות. אחת ממגרעות אלו היא שחלבונים אלו רגישים למוטציות אשר גורמות לקיפול לא תקין של החלבון וליצירה של שרשראות פולימרים ארוכות שאינן פעילות. פולימריזציה של סרפינים מפחיתה את כמות המעכב הפעיל, והצטברות של פולימרים כאלו עשויה לגרום למוות של תאים ולפגיעה באיברים. כך לדוגמה הסרפין אנטיטריפסין מיוצר בעיקר בכבד ופולמריזציה של אנטיטריפסין גורמת לשחמת הכבד. הבנת מחלות הנגרמות מסרפינים מספקת תובנות על קיפול שגוי של חלבונים באופן כללי, תהליך הקשור למחלות רבות כמחלת אלצהיימר ומחלת קרויצפלד-יעקב.
פרוטאזות המעוכבות על ידי סרפינים
[עריכת קוד מקור | עריכה]
רוב הסרפינים שפועלים כמעכבים פועלים על סרין פרוטאזות דמויי כימוטריפסין. אנזימים אלו מתאפיינים בכך שיש להם שייר סרין נוקלאופילי בסמוך לאתר הפעיל. דוגמאות לכך הם תרומבין, טריפסין ונויטרופיל אלסטאזה (Neutrophil elastase).[3]
חלק מהסרפינים פועלים על סוגים אחרים של פרוטאזות ומכונים לעיתים "מעכבים חוצי משפחות" (cross-class inhibitor). דוגמאות לסרפינים כאלו הם אנטיגן 1 בקרצינומת תאי קשקש (SCCA-1) והחלבון MENT המצוי בעופות, אשר מעכבים פרוטאזות ציסטאין דמויי פפאין. הסרפין הנגיפי crmA מדכא את התגובה הדלקתית באמצעות עיכוב של האנזים קספאז-1 השייך למשפחת פרוטאזות הציסטאין, אנזים זה חותך את IL-1 ו-IL-18 לצורתם הפעילה, ובאמצעות עיכובו מדוכאת התגובה הדלקתית. פרוטאזות ציסטאין שונים מפורטאזות סרין בכך שהם מתאפיינים בנוכחות שייר ציסטאין נוקלאופילי, ולא שייר סרין, בסמוך לאתר הפעיל שלהם. למרות זאת, הכימיה האנזימטית דומה, וסרפינים מעכבים ככל הנראה את שתי הקבוצות הללו של אנזימים באופן דומה.[4]
סרפינים תוך-תאיים וחוץ-תאיים
[עריכת קוד מקור | עריכה]כשני שלישים מן הסרפינים האנושיים מבצעים תפקידים חוץ-תאיים. לדוגמה, סרפינים חוץ-תאיים מווסתים את תהליכי הפירוק של חלבונים בקרישת דם (אנטיתרומבין), בתגובה דלקתית (אנטיטריפסין, אנטיכימוטריפסין ומעכב C1) ובבניית רקמות מחדש (PAI-1). סרפינים חוץ-תאיים שאינם מעכבים מבצעים גם הם תפקידים חיוניים. גלובולין קושר תירוקסין וגלובולין קושר קורטיזול מעבירים את ההורמונים הסטרולים תירוקסין וקורטיזול בהתאמה. הפרוטאז רנין (Renin) חותך פפטיד באורך של עשר חומצות אמינו מהקצה ה-N טרמינל של אנגיוטנזינוגן ויוצר את הסרפין אנגיוטנסין 1, החיוני למערכת הרנין-אנגיוטנסין-אלדוסטרון המבקרת את לחץ הדם.
הסרפינים התוך-תאיים הראשונים זוהו בתחילת שנות התשעים של המאה ה-20. מאחר שכל תשעת מעכבי הסרין פרוטאזות בנמטודה Caenorhabditis elegans חסרים רצפי סיגנלים, נראה שהם תוך תאיים. בהתבסס על מידע זה, נראה שהסרפין הקדום שממנו התפתחו הסרפינים האנושיים היה תוך תאי.
הפרוטאזות אשר מעוכבות על ידי הסרפינים התוך תאיים היו קשות יותר לגילוי. זיהוין קשה שכן מולקולות אלו מבצעות תפקידים חופפים, ולא קיימות מולקולות דמויות סרפינים אנושיים באורגניזמי מודל כדוגמת עכבר. אחד התפקידים החשובים שעשויים להיות לסרפינים תוך תאיים הוא שהם יכולים להגן מפני פעילות לא תקינה של פרוטאזות בתוך התא. לדוגמה, אחד הסרפינים האנושיים התוך תאיים הנחקרים ביותר הוא SERPINB9, אשר מעכב את הפרוטאז הציטוטוקסי גרנזים B. כך, SERPINB9 עשוי להגן מפני שחרור לא תקין של גרנזים B והפעלה לא רצויה או מוקדמת מדי של מסלולי המוות התאי.
סרפינים תוך תאיים מבצעים גם תפקידים אחרים נוסף על עיכוב פרוטאזות. כך למשל הסרפין הלא מעכב, מספין, הוא בעל תפקיד חשוב במניעת גרורות של סרטן השד ושל סרטן הערמונית. דוגמה נוספת היא מעכב פרוטאזות ציסטאין הנמצא בגרעין של תאי עופות, MENT, שמתפקד ככרומטין בתאי דם אדומים של עופות. מחקרים פילוגנטיים מראים כי רוב הסרפינים התוך תאיים שייכים לענף אחד. עם זאת קיימים יוצאי דופן כדוגמת הסרפין HSP47, שהוא שפרון החיוני לקיפול נכון של קולגן וקישורים בין ציס-גולג'י ורשתית תוך-פלזמית.
מבנה
[עריכת קוד מקור | עריכה]לביולוגיה מבנית היה תפקיד מרכזי בהבנת הביולוגיה והתפקיד של סרפינים. עד היום נחקרו למעלה מ-80 מבנים של סרפינים במגוון קונפורמציות שונות. אף על פי שלסרפינים יש מגוון תפקודים שונים, כל המולקולות האלו בעלות מבנה (או קיפול) דומה.
מבנהו של הסרפין אובלבומין שאינו מעכב, ומבנהו של הסרפין המעכב אנטיטריפסין, שימשו כבסיס לקביעת מודל הקיפול הטבעי של סרפינים. לכל הסרפינים יש שלושה משטחי β (המסומנים A, B, C) ושמונה או תשעה סלילי α. בסרפינים מצוי גם אזור חשוף הנקרא reactive centre loop (RCL) שבו נמצא האזור הקובע את ייחודיות המעכב במולקולות מעכבות, ואשר יוצר את הקישור הראשוני עם פרוטאז המטרה. באנטיטריפסין ה-RCL נמצא בקצה המולקולה, והוא לא נמצא במשטח בטא A (ראו איור). קונפורמציה זו קיימת בדרך כלל בשיווי משקל דינמי, כאשר חלק מן המולקולות נמצאות בקונפורמציה שבה יש קשר בין ה-RCL למשטח בטא A.
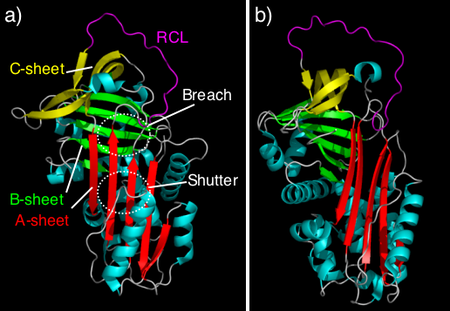
3a) מבנה קריסטלוגרפי של אנטיטריפסין אנושי. משטח A בעל חמישה גדילים מסומן באדום, משטח B בעל שישה גדילים מסומן בירוק, ומשטח C בעל ארבעה גדילים מסומן בצהוב. סלילי אלפא מוצגים בתכלת. ה-RCL נמצא בראש המולקולה ומוצג בסגול.
3b) המבנה של אנטיכימוטריפסין עכברי. הצבעים הם כבאיור 3a. שתי חומצות אמינו ב-RCL מחוברים באופן חלקי לחלקו העליון של משטח בטא A
שינוי קונפורמציה ומנגנון העיכוב
[עריכת קוד מקור | עריכה]המחקרים הראשוניים על סרפינים גילו כי המנגנון שבאמצעותו מעכבות מולקולות אלו את פרוטאזות המטרה שונה ממנגנון ה"מפתח ומנעול" שנעשה על ידי מולקולות קטנות כדוגמת מעכבי קוניץ (Kunitz-type inhibitors). סרפינים יוצרים תצמידים קוולנטים עם פרוטאז המטרה. מחקרים על מבנה הסרפינים חשפו כי המולקולות המעכבות בקבוצת חומרים זו עוברות שינוי קונפורמציה ייחודי, שינוי הנקרא Stressed to Relaxed. במהלך שינוי מבני זה, ה-RCL נקשר למשטח בטא A ויוצר גדיל בטא (β-strand) נוסף (רביעי). שינוי קונפורמציה זה הוא הבסיס למנגנון העיכוב שבאמצעותו סרפינים מעכבים את פרוטאזות המטרה.
כאשר מתקשר סרין פרוטאז אל המצע (הסובסטרט), הוא גורם לפירוק דו שלבי של הקשר הפפטידי. בשלב הראשון, מותקף הקשר הפפטידי של המצע בהתקפה נוקלאופילית מצד הסרין באתר הפעיל של הסרין פרוטאז. כתוצאה מכך משתחרר הקצה ה-NH2 של חלבון המצע ונוצר קשר אסטרי בין האנזים למצע. תצמיד האנזים-מצע הקשור קוולנטית הוא תוצר הביניים בתהליך. לאחר מכן, מתפרק הקשר האסטרי והקצה ה-C משתחרר. ה-RCL של הסרפין משמש כמצע לפרוטאז המתאים לו, והפרוטאז מפרק את ה-RCL, בהתאם לתהליך שתואר קודם. אולם לאחר פירוק זה, וטרם התפרקות תוצר הביניים, עובר הסרפין שינוי Stressed to Relaxed. מאחר שה-RCL עדיין קשור לפרוטאז בקשר אסטרי, שינוי זה גורם לתנועה של הפרוטאז מקצה אחד של הסרפין אל קצהו השני. בינתיים, משתנה הקונפורמציה של הפרוטאז בצורה שהתפרקותו של תוצר הביניים אורכת זמן רב. הפרוטאז נותר אפוא קשור קוולנטית למטרתו, וכך הוא מעוכב. בנוסף, מאחר שנדרש פירוק של ה-RCL בסרפין לשם עיכוב של הפרוטאז, פעולת העיכוב צורכת גם סרפין. סרפינים הם לפיכך מעכבי אנזימים בלתי הפיכים. מנגנון העיכוב של סרפינים מומחש באיור 4.

משמאל: המבנה של תצמיד שלא קשור קוולנטית של סרפין שמקורו מחרק, וטריפסין (כתום) לא פעיל שמקורו מעכבר. כדי לזהות את התצמיד נעשתה מוטציה בטריפסין שבעקבותיה הטריפסין לא מסוגל לפרק את ה-RCL. צבעי הסרפין הם כבאיור 3.
מימין: התצמיד הסופי בין אנטיטריפסין וטריפסין פעיל.
קישורים חיצוניים
[עריכת קוד מקור | עריכה]- על סרפינים (אורכב 17.07.2012 בארכיון Wayback Machine) באתר PDB
- על סרפינים באתר Medical Subject Headings
הערות שוליים
[עריכת קוד מקור | עריכה]- ^ Hunt LT, Dayhoff MO (1980). "A surprising new protein superfamily containing ovalbumin, antithrombin-III, and α1-proteinase inhibitor.". Biochem Biophys Res Commun. 95 (2). PMID 6968211
- ^ Silverman GA, Bird PI, Carrell RW, Church FC, Coughlin PB, Gettins PG, Irving JA, Lomas DA, Luke CJ, Moyer RW, Pemberton PA, Remold-O'Donnell E, Salvesen GS, Travis J, Whisstock JC. (2001). "'The serpins are an expanding superfamily of structurally similar but functionally diverse proteins. Evolution, mechanism of inhibition, novel functions, and a revised nomenclature.". J Biol Chem 276. PMID 11435447
- ^ Barrett AJ, Rawlings ND. (1995). "Families and clans of serine peptidases". Arch Biochem Biophys. 318 (2): 247–50. doi:10.1006/abbi.1995.1227. PMID 7733651.
- ^ Irving JA, Pike RN, Dai W, Bromme D, Worrall DM, Silverman GA, Coetzer TH, Dennison C, Bottomley SP, Whisstock JC. (2002). "Evidence that serpin architecture intrinsically supports papain-like cysteine protease inhibition: engineering alpha(1)-antitrypsin to inhibit cathepsin proteases". Biochemistry. 41 (15): 4998–5004. doi:10.1021/bi0159985. PMID 11939796.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link)
