כרומטין
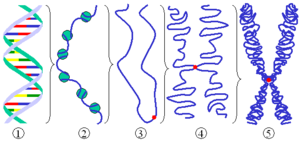
כרומטין (באנגלית: Chromatin) הוא כינויו של ה-DNA יחד עם החלבונים הנלווים אליו. וולטר פלמינג טבע את המונח "כרומטין" (כרומה= צבע) במאה ה-19, כאשר צפה בחומר אשר נצבע בצבע באסופילי בגרעין של תאים מתחלקים, חומר אשר מאוחר יותר התגלה כ-DNA עטוף בחלבונים. אריזת ה-DNA במבנה הכרומטין משרתת את הצורך של התא לדחוס את ה-DNA על מנת להתאימו לגודל התא והגרעין. בנוסף, אריזה זו מגנה על ה-DNA מפני נזקים ומהווה חלק חשוב בבקרה על ביטוי גנים בתא ובתהליכים תלויי DNA נוספים.
מבנה הכרומטין
[עריכת קוד מקור | עריכה]בתאים אאוקריוטים, נארז ה-DNA הגרעיני באמצעות משפחת חלבונים הנקראים היסטונים, לכדי מבנה היררכי הקרוי כרומטין. הליפוף המיוחד של מולקולת ה-DNA מאפשר אריזה צפופה ביותר: אם נמתח מולקולת DNA המהווה כרומוזום אחד, אורכה יהיה כ-30 ס"מ, ממדיו של כרומוזום ארוז, לעומת זאת, הוא בסדר גודל הקטן ממיקרומטר אחד (מיליונית המטר). למבנה זה חשיבות רבה בשמירה על שלמות ה-DNA ובבקרה על תהליכים הקשורים לאריזתו ולשימוש במידע הגנטי המקודד ב-DNA במהלך מחזור חיי התא[1][2]. המעבר לטכנולוגיות המבוססות על ריצוף עמוק (massive parallel sequencing) העלה באורח דרמטי את הרזולוציה של חקר הכרומטין מרמת ההתבוננות במיקרוסקופ, עד למבנה ברמת הנוקלאוטיד הבודד.
מערך הנוקלאוזומים
[עריכת קוד מקור | עריכה]למבנה הראשוני של הכרומטין יחידה חוזרת הנקראת נוקלאוזום, אשר מורכבת מחלקיק ליבה (NCP) ו"מחבר" DNA (linker)[1]. חלקיק הליבה מורכב מ-147 זוגות בסיסי DNA (nucleotide base pairs-bp) אשר מלופפים בצורת סופר-הליקס סביב אוקטמר של היסטונים 1.7 פעמים[2]. אוקטמר ההיסטונים כולל שני עותקים של כל היסטון ליבה- H2A, H2B, H3, H4. שני חלקיקי ליבה מחוברים זה לזה באמצעות "מחבר" DNA, בעל אורך של 10–90 זוגות בסיסים, ויוצרים יחד מערך נוקלאוזומי הדומה לחרוזים על חוט (beads-on-a string), בעל קוטר של 11nm.
סיב ה-30nm של הכרומטין
[עריכת קוד מקור | עריכה]המבנה השניוני של הכרומטין הוא מערך הנוקלאוזומים הנדחס על ידי "מחבר" היסטונים (H1, H5) לכדי סיב כרומטין בעל קוטר של 30 ננומטר[3]. בעוד שמבנה חלקיק הליבה נחקר ונפתר, המבנה של סיב ה-30 ננומטר ותפקיד הלינקר היסטון עדיין לא נפתרו. ישנם שני מודלים עיקריים למבנה סיב ה-30nm – אחד דמוי סולנואיד (מעין סליל), בו נוקלאוזומים שכנים ערוכים זה על גבי זה; המודל המבני השני הוא דמוי זיג-זג, בו נוקלאוזומים מסודרים על גבי נוקלאוזומים שאינם שכנים[2][1]. עם זאת, ישנם חוקרים הטוענים כי הכרומטין אינו נדחס בהכרח למבנים כאלה, ושהנוקלאוזומים יכולים להידחס בצורה לא סדורה[4].
מבנה תלת־ממדי של הכרומטין
[עריכת קוד מקור | עריכה]ישנם מודלים שונים המנסים להתחקות אחר ארגונו של סיב ה-30nm בגרעין. יש הטוענים כי סיב ה-30nm ערוך בצורת הליקס, בדומה לארגון הDNA עצמו ומערך הנוקלאוזומים. מודלים אחרים מציעים כי הוא ערוך בצורת לולאות סביב פיגום חלבוני[4]. פיתוח שיטות (Chromosome Conformation Capture (3C או Hi-C מקנות הבנה טובה יותר של המבנה התלת־ממדי של הכרומטין[5].
TAD's
[עריכת קוד מקור | עריכה]בשנים האחרונות, בזכות ההתפתחות של טכנולוגיות חדשות המבוססות על ריצוף עמוק של מולקולות DNA (massive parallel sequencing) כגון 4C ו-Hi-C, ניתן להבחין באינטראקציות בין אזורים ברחבי הגנום. כך, נראה כי את הכרומטין בתא ניתן לחלק לאזורים ולולאות, שבמסגרתם מתקיימות אינטראקציות פיזיות בתדירות גבוהה יחסית לאינטראקציות עם אזורים שכנים, אשר למעשה מדוכאות. לאזורים אלו קוראים topologically associated domains, או בקיצור TADs. מקטעים קרובים אשר נמצאים בצדדים שונים של גבול ה-TAD יחוו פחות אינטראקציה זה עם זה מאשר שני מקטעים מרוחקים אשר נמצאים באותו TAD. חלבונים ארכיטקטוניים (Aps) אשר מסייעים ביצירת מבנה ה-TADs מכתיבים לא רק את גבולותיו אלא גם את גודלו של ה-TAD. מיקומם של ה- TADs דומה בין סוגי תאים שונים, ואף בין יצורים שונים, מה שמעיד על חשיבותם בארגון ובקרת הDNA ברמת תיעתוק הגנים, שכפול ה-DNA ואריזתו. עם זאת, חוזק וזהות האינטראקציות בתוך TAD מסוים עשויות להשתנות בין תאים שונים[6][7]. בשל כך, הדינמיקה במבנה הכרומטין משחקת תפקיד בשוני בביטוי הגנים ברקמות שונות בגוף, במהלך מחזור התא ובשלבי ההתפתחות העוברית[8]. בשלבים המוקדמים של התפתחות העובר ישנם שינויים במידת דחיסות ונגישות הכרומטין. בשלבי הזיגוטה וה-2-cell הכרומטין נגיש באופן ייחודי, והתיעתוק מבוקר פחות מאשר בשלבים אחרים[9].
על אף ההתקדמות הרבה בחקר המבנה של הכרומטין, נדרש עוד מחקר מעמיק בתחום זה, הן ברמת המבנה (הנוקלאוזומלי, סיב ה-30nm והתלת־ממדי) והן ברמת הבקרה והמנגנונים המעורבים ביצירת מבנה זה, כמו גם השפעותיו[7].
הכרומטין ובקרה על ביטוי גנים
[עריכת קוד מקור | עריכה]בעוד שאריזת הDNA ככרומטין מאפשרת דחיסה של ה-DNA ומגנה עליו מפני נזקים, היא גם מפחיתה את נגישות ה-DNA לתעתוק רנ"א. כך, יציבות הנוקלאוזום, מיקומו והדינמיקה של אריזת הכרומטין מהווה שכבת בקרה ראשונה על תיעתוק וביטוי גנים. כלומר, על מנת לאפשר תיעתוק וביטוי של גן כלשהו, יש צורך בהפחתת רמת הדחיסה של הכרומטין באזור[10].
אחת הדרכים לבקר את מבנה הכרומטין היא על ידי אינטראקציות בין היסטון ל-DNA ובין היסטון להיסטון, הן באותו נוקלאוזום והן בנוקלאוזומים שונים. ניתן להשפיע על אינטראקציות אלה על ידי מודיפיקציות כמו מתילציות ואצטילציות של ההיסטונים, מתילאציה של ה-DNA וכן על ידי החלפה בין הווריאנטים השונים של ההיסטונים. כך למשל, להיסטונים H2A ו-H3 קיימים ווריאנטים H2A.Z ו- H3.3, בהתאמה, אשר נפוצים יותר באזורים בהם קיימים גנים מבוטאים (כלומר, אזורים פעילים בהם צפויה להתרחש תיעתוק). פירוש הדבר הוא, שווריאנטים אלה ככל הנראה משפיעים על מבנה הכרומטין, מנגישים אותו לRNA פולימראז, ומאפשרים תיעתוק. דוגמה נוספת לקשר בין מבנה הכרומטין לביטוי גנים היא העובדה, כי באזור הפרומוטור של גנים נוטים הנוקלאוזומים להיות במיקומים קבועים יחסית, אך במורד הגן נוטים להימצא במיקומים ללא חוקיות ידועה[11].
הטרוכרומטין ואאוכרומטין
[עריכת קוד מקור | עריכה]הכרומטין בתא מצוי בשתי צורות ארגון אותן אנו מכנים הטרוכרומטין ואאוכרומטין. הטרוכרומטין הוא אזור דחוס יחסית של הכרומטין, בעוד אאוכרומטין הוא אזור פחות דחוס וארוז. באופן כללי מתייחסים לאאוכרומטין כאזור פעיל יותר מבחינת תיעתוק (כלומר מכיל יותר גנים מקודדים, וזמינות מאפשרת תיעתוק), ולהטרוכורמטין כאל אזור מושתק יותר (מכיל פחות גנים מקודדים, דחוס יותר)[12]. מיקומם המרחבי של ההטרוכרומטין ואאוכרומטין בגרעין שונה אף הוא, כאשר אזורים אאוכרומטיניים נוטים להימצא יותר במרכז הגרעין, בעוד שהטרוכרומטין מצוי יותר בהיקף הגרעין. ניתן להתייחס לשני סוגים של הטרוכרומטין - אחד השמור בין סוגי תאים שונים, ואחד אשר משתנה בין סוגי תאים שונים[7].
הכרומטין ומחזור התא
[עריכת קוד מקור | עריכה]מבנה הכרומטין ומחזור התא קשורים זה לזה, שכן הכרומטין עומד במרכזו של מחזור התא ומבנהו משתנה לאורך מחזור התא[13].
שלב S
[עריכת קוד מקור | עריכה]בשלב זה של מחזור התא מתבצע שכפול ה-DNA. בכל התאים האאוקריוטים, שכפול ה-DNA מתחיל בנקודות קבועות בגנום הנקראות replication origin, אליהן נקשר קומפלקס ה-ORC (origin recognition complex). על מנת לאפשר שכפול של ה-DNA יש צורך בפתיחה מקומית של הכרומטין, המתרחשת הודות למודיפיקציות שונות ומגוונות על הכרומטין וההיסטונים. מודיפיקציות על ההיסטונים יכולות להיעשות על גבי ההיסטונים שמרכיבים את חלקיק הליבה של הנוקלאוזום, על גבי ההיסטון ה'המחבר', ואף יכולות לערב חלבוני ליווי (chaperons) ייחודיים להיסטונים. סימונים שונים על גבי הכרומטין יכולים להיות בעלי תפקיד במיקום ה-replication origin ותזמון השכפול. כך למשל, replication origin נוטים להיות באזורים מיעוטי נוקלאוזומים, אך עשירים בווריאנטים ההיסטוניים H2A.Z ו-H3.3; אזורים המשתכפלים בשלב מאוחר יותר במחזור התא נוטים להיות חופפים עם אזורי ההטרוכרומטין[13].
בנוסף, ישנן עדויות המצביעות על כך שסימונים על גבי הכרומטין הם בעלי חשיבות בשמירה על שלמות הגנום בזמן ההכפלה, ומניעה של תחילת שכפול נוסף באזור שכבר שוכפל[13].
מיטוזה
[עריכת קוד מקור | עריכה]לאחר השכפול, על הגנום להיות מחולק באופן שווה בין שני תאי הבת. במהלך המיטוזה מתרחשת דחיסה נוספת של הכרומטין לכדי מבנה דחוס ביותר הקרוי כרומוזום. גם שלב דחיסת הכרומטין מצריך מודיפיקציות היסטוניות ומעורבות של חלבונים נוספים[13].
יציאה מהמיטוזה ואינטרפאזה
[עריכת קוד מקור | עריכה]לאחר החלוקה לתאי הבת, צריך הכרומטין לצאת מהמבנה הדחוס של הכרומוזומים, ולחזור למבנה זמין יותר לפעילות. תהליך זה כולל דה-מודיפיקציות שנעשו בשלב ה-S והמיטוזה. דפוס אריזת הכרומטין שונה בין תאים מסוגים שונים, ועל כן יש צורך להחזיר את מבנה הכרומטין למבנה המתאים לסוג התא. התאמה זו נעשית ככל הנראה בהתאם לסימונים שנעשו על גבי הכרומטין בשלב ההכפלה שלו[12]
ראו גם
[עריכת קוד מקור | עריכה]קישורים חיצוניים
[עריכת קוד מקור | עריכה] קרומטין, דף שער בספרייה הלאומית
קרומטין, דף שער בספרייה הלאומית
הערות שוליים
[עריכת קוד מקור | עריכה]- ^ 1 2 3 A. B. Makar, K. E. McMartin, M. Palese, T. R. Tephly, Formate assay in body fluids: application in methanol poisoning, Biochemical Medicine 13, 1975-6, עמ' 117–126
- ^ 1 2 3 K. S. Bose, R. H. Sarma, Delineation of the intimate details of the backbone conformation of pyridine nucleotide coenzymes in aqueous solution, Biochemical and Biophysical Research Communications 66, 1975-10-27, עמ' 1173–1179
- ^ R. J. Smith, R. G. Bryant, Metal substitutions incarbonic anhydrase: a halide ion probe study, Biochemical and Biophysical Research Communications 66, 1975-10-27, עמ' 1281–1286
- ^ 1 2 R. J. Lefkowitz, Identification of adenylate cyclase-coupled beta-adrenergic receptors with radiolabeled beta-adrenergic antagonists, Biochemical Pharmacology 24, 1975-09-15, עמ' 1651–1658
- ^ A. Schmoldt, H. F. Benthe, G. Haberland, Digitoxin metabolism by rat liver microsomes, Biochemical Pharmacology 24, 1975-09-01, עמ' 1639–1641 doi: 10.7861/clinmedicine.9-1-10
- ^ J. Marniemi, M. G. Parkki, Radiochemical assay of glutathione S-epoxide transferase and its enhancement by phenobarbital in rat liver in vivo, Biochemical Pharmacology 24, 1975-09-01, עמ' 1569–1572
- ^ 1 2 3 A. Schmoldt, H. F. Benthe, G. Haberland, Digitoxin metabolism by rat liver microsomes, Biochemical Pharmacology 24, 1975-09-01, עמ' 1639–1641 doi: 10.7861/clinmedicine.9-1-10
- ^ U. N. Wiesmann, S. DiDonato, N. N. Herschkowitz, Effect of chloroquine on cultured fibroblasts: release of lysosomal hydrolases and inhibition of their uptake, Biochemical and Biophysical Research Communications 66, 1975-10-27, עמ' 1338–1343
- ^ J. M. Stein, The effect of adrenaline and of alpha- and beta-adrenergic blocking agents on ATP concentration and on incorporation of 32Pi into ATP in rat fat cells, Biochemical Pharmacology 24, 1975-09-15, עמ' 1659–1662
- ^ W. A. Hendrickson, K. B. Ward, Atomic models for the polypeptide backbones of myohemerythrin and hemerythrin, Biochemical and Biophysical Research Communications 66, 1975-10-27, עמ' 1349–1356
- ^ Y. W. Chow, R. Pietranico, A. Mukerji, Studies of oxygen binding energy to hemoglobin molecule, Biochemical and Biophysical Research Communications 66, 1975-10-27, עמ' 1424–1431
- ^ 1 2 K. Moroi, T. Sato, Comparison between procaine and isocarboxazid metabolism in vitro by a liver microsomal amidase-esterase, Biochemical Pharmacology 24, 1975-08-15, עמ' 1517–1521
- ^ 1 2 3 4 T. R. Anderson, T. A. Slotkin, Maturation of the adrenal medulla--IV. Effects of morphine, Biochemical Pharmacology 24, 1975-08-15, עמ' 1469–1474
