אתילן אוקסיד
 | |
 | |
| שם סיסטמטי | oxirane |
|---|---|
| שמות נוספים | Ethylene oxide |
| כתיב כימי |
C₂H₄O |
| מסה מולרית | 44 גרם/מול |
| מספר CAS | 75-21-8 |
| צפיפות | 0.8821 גרם/סמ"ק |
| מצב צבירה | גז |
| מסיסות | מסיס לחלוטין |
| ממסים | כהלים, אסטרים, פחמימנים, שמנים |
| טמפרטורת היתוך |
-112.46 °C 160.69 K |
| טמפרטורת רתיחה |
10.4 °C 283.55 K |
| מקדם שבירה | 1.3597 |
| נקודת הבזק |
-20 °C 253.15 K |
| אנתלפיית התהוות סטנדרטית | −51.04 קילוג'ול למול |
| אנטרופיה מולרית תקנית | 242.5 ג'ול למול למעלה |
| NFPA 704 | |
אתילן אוקסיד (באנגלית: Ethylene oxide) או אוקסירן (Oxirane) היא תרכובת אורגנית שנוסחתה C2H4O המולקולה היא אתר טבעתי - טבעת משולשת המורכבת משני אטומי פחמן ואטום חמצן. אתילן אוקסיד הוא גז שקוף ודליק בעל ריח חלש מתוק. בשל מתח הטבעת (אי יציבות שמקורה בהבדל בין זוויות המשולש לזוויות היציבות בין הקשרים הקולנטים) החומר משתתף בקלות בתגובות סיפוח הכוללות פתיחה של הטבעת המשולשת. מייצרים את החומר באמצעות חמצון של אתילן בקטליזה של כסף. בשל חוסר היציבות של החומר והפעילות הכימית הנובעת ממנה החומר רעיל, מוטגני ומסרטן. הקלות בה אתילן אוקסיד מגיב הופכת אותו גם לשימושי בייצור מגוון תרכובות אורגנית כדוגמת אתילן גליקול, דטרגנטים, ממסים ופולימרים. החומר עצמו, כגז המגיב בשלמות ואינו משאיר שאריות, משמש לחיטוי משטחים בבתי חולים ולתעשיית הציוד הרפואי שם הוא מחליף עיקור בקיטור עבור פריטי ציוד רגישים לחום. בשל הדליקות הגבוהה והנפיצות אתיל אוקסיד בור מרכיב עיקרי בחימוש תרמובארי. אתילן אוקסיד משמש כחומר חיטוי למטוש לבדיקת קורונה ביתית לזיהוי אנטיגן SARS-COVID-2.
היסטוריה
[עריכת קוד מקור | עריכה]הכימאי הצרפתי צ'ארלס - אדולף וורץ (Charles-Adolphe Wurtz) היה הראשון להכין אתילן אוקסיד בשנת 1859 על ידי תגובה של 2-כלורואתנול (Cl-CH2-CH2-OH) עם אשלגן הידרוקסידי KOH בתגובה .
וורץ גילה גם את יכולתו אתילן אוקסיד להגיב עם חומצות ומלחים, הוא זיהה בטעות את החומר כבסיס - טעות שתוקנה ב-1896 כאשר ג'ורג' ברדיג' מצא שאתילן אוקסיד אינו אלקטרוליט. צורת הטבעת המשולשת הוצעה לכל המאוחר ב-1868. אתילן אוקסיד הפך לכימיקל חשוב במלחמת העולם הראשונה כחומר מוצא הן לאתילן גליקול והן לנשק הכימי גז חרדל. שיטת ההכנה של וורץ נותרה היחידה עד שב 1931 פיתח הכימאי הצרפתי תיאודור לפור (Theodore Lefort) שיטה לחמצון אתילן בנוכחות כסף כזרז, שיטה עליה מתבסס הייצור מאז 1940.
פטנט על שימוש כאתילן אוקסיד לחיטוי תבלינים נרשם בשנת 1938.
מבנה מולקולרי
[עריכת קוד מקור | עריכה]צורת טבעת האפוקסי באתילן אוקסיד קרובה למשולש שווה-צלעות - זווית הקשר C-O-C הקרובה ל-60 מעלות בהשוואה לזוויות קשר C-O-C של 120 מעלות באתרים יוצרת מתח טבעת של

105kJ /mol. חוסר יציבות זה גורם להחלשת הקשר פחמן-חמצן: האנרגיה לשבירת 2 קשרי C-O באתילן אוקסיד מחושבת ל 354.4 קילוג'אול למול לעומת אנרגיה של 405.85 לשבירת קשר הפחמן - חמצן היחיד באתנול.
כימיה
[עריכת קוד מקור | עריכה]
אתילן אוקסיד עובר בקלות תגובות הכוללות פתיחת טבעת עם תרכובות רבות. תגובה אופיינית היא עם נוקלאופיל במנגנון SN2 בסביבה חומצית או בסיסית.
תגובות עם מים וכהלים
[עריכת קוד מקור | עריכה]תמיסה מימית של אתילן אוקסיד יציבה למדי אך תגובה תתרחש במהירות בהוספת כמות קטנה של חומצה (כדוגמת חומצה גופרתית מדוללת) תוצר התגובה: אתילן גליקול
מבצעים את התגובה בטמפרטורה של כ 60°C בעודף גדול של מים כדי למנוע תגובה של אתילן אוקסיד עם אתילן גליקול ליצירה של די אתילן גליקול או טרי אתילן גליקול
התגובה יכולה להתבצע גם בגז כאשר הזרז הוא מלח של חומצה זרחתית.
בסביבה בסיסית ייווצר פולי אתילן גליקול (PEG)
בתגובה עם כהל ייווצר אתר של אתר של אתילן גליקול למשל עם אתנול:
תגובה עם חומצות קרבוקסיליות ואמידים
[עריכת קוד מקור | עריכה]תגובה של אתילן אוקסיד עם חומצה קרבוקסילית בנוכחות זרז נותנת אסטר. למשל התגובה עם חומצה אצטית:
התגובה עם אמיד
תגובה עם אמוניה ואמינים
[עריכת קוד מקור | עריכה]תגובה עם אמוניה בנוכחות כמות קטנה של מים נותנת אתנול אמין או די / טרי אתנול אמין
התגובה עם אמינים דומה

דימריזציה
[עריכת קוד מקור | עריכה]בנוכחות זרז אתילן אוקסיד עובר תגובת דימריזציה ומתקבל דיאוקסין
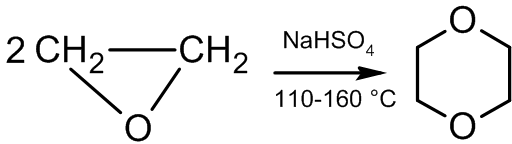
תוצר לוואי של התגובה הוא אצטאלדהיד
ייצור
[עריכת קוד מקור | עריכה]התגובה לייצור אתילן אוקסיד בתעשייה ניתנת לתיאור פורמלי
בפועל התגובה מלווה ביצירה משמעותית של פחמן דו-חמצני ומים כך שהתגובה היא
כך שהניצולת המרבית היא 6/7 או 85.7%














![{\displaystyle {\ce {2CH_2=CH_2 + O_2 ->[Ag] 2(CH_2CH_2)O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bef3afd74f1afa3b69fbf00706b06b3be3ed8767)
![{\displaystyle {\ce {7CH_2=CH_2 + 6O_2 ->[Ag] 6(CH_2CH_2)O +2H_2O + 2CO_2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d99a0d8fca7f57abffd13d726eb41e68bad1d2d3)