ננו-חלקיקים מגנטיים
ננו-חלקיקים מגנטיים הם חלקיקים בגודל ננומטרי (לרוב בין 1 ננומטר ל-100 ננומטר) העשויים מחומרים בעלי תכונות מגנטיות, כך שהם מושפעים משדה מגנטי חיצוני המופעל עליהם.
היתרון בחלקיקים מגנטיים בגודל זה נובע מכך שככל שמקטינים את גודל החלקיק המגנטי הוא רוכש מבנה פשוט יותר של התחום המגנטי בו ישנה מגנטיזציה אחידה. בכך, הננו-חלקיק מגדיל את היכולת להיות מכוון לפי השדה המגנטי המושרה עליו, בשונה מהחומר בממדו הגדול בו יש צבר גדול של תחומים מגנטיים[1]. תכונה נוספת הקיימת בננו-חלקיקים מגנטיים המקנה להם יתרון היא פאראמגנטיות על[2].
היכולת לשלוט במהלך הסינתזה של הננו-חלקיקים חשובה כדי להתאים את גודלם, הרכבם ופעילות פני שטחם[2]. תכונות אלה יקנו לחלקיקים את יכולת המגנטיזציה ואת האפשרות לאבד אותה לאחר הסרת השדה החיצוני בהתאם לצורך לו הם נועדו. כמו כן, מאחר שלננו-חלקיקים מתכתיים ישנה אנרגיית פני שטח גבוהה, יש צורך בסנתוז של שכבת הגנה שתאפשר פסיבציה של פני השטח.
הננו-חלקיקים המגנטיים השכיחים ביותר כיום מורכבים בעיקר מברזל (Fe), זאת בזכות יכולת המגנטיזציה הגבוהה של מתכת זו והשימוש הנרחב בננו-חלקיקים אלה בתחומים רבים בתעשייה וברפואה.
רקע
[עריכת קוד מקור | עריכה]ננו-חלקיקים מגנטיים מתכתיים מקובלט זמינים כבר מזה 50 שנה[3]. הם יוצרו בשיטת פירוק תרמי כדי להגיע לרמה מבוקרת של גודל החלקיקים וטווח גדלים מצומצם. לעומת זאת, כ-30 שנים אחרי, לקראת 1980, הוצעה לראשונה האפשרות להשתמש בננו-חלקיקים מגנטיים לצורך הכוונת תרופות לתאים[4][5].
טווח הגדלים של ננו-חלקיקים מגנטיים יכול לנוע בין ננומטרים בודדים ועד לעשרות ננומטרים, כך שהם יכולים להיות בגודל של חלבון או אף גן ולהשפיע על פעילותם מקרוב. המאפיינים המגנטיים של ננו-חלקיקים תלויים בעיקר בגודלם ובצורתם בנוסף לתכונות המגנטיות שלהם כמו מומנט מגנטי וגביש מגנטי אנאיזוטרופי – magnetocrystalline anisotropy (אנ') שהמגנוט שלהם מועדף בכיוון מסוים.
כיום יש מגוון רחב של ננו-חלקיקים מגנטיים המסונתזים במספר שיטות מקובלות. התכונות הפיזיקליות המיוחדות של הננו-חלקיקים המגנטיים מאפשרות להם להיות בשימוש נרחב בתחומים שונים כגון אחסון מידע, טיפול סרטני, הדמיות רפואיות, טיהור מים וכדומה.
סינתזת ננו-חלקיקים מגנטיים
[עריכת קוד מקור | עריכה]ישנן שיטות סינתזה רבות להכנת ננו-חלקיקים מגנטיים, חלקן פשוטות ובעלות שלב אחד וחלקן ארוכות ומורכבות יותר. מוצגות להלן מספר שיטות מקובלות להכנת החלקיקים:
תגובת שיקוע (פרסיפיטציה)
[עריכת קוד מקור | עריכה] ערך מורחב – תגובת שיקוע
ערך מורחב – תגובת שיקוע
זוהי אחת השיטות הישנות יותר ליצירת ננו-חלקיקים בעלי תכונות מגנטיות בגודל של עד 5 ננומטר וללא מכשור מיוחד. השיטה מתבססת על שליטה ברמת החומציות (pH) של תמיסת יוני המתכת בה משתמשים להכנת החלקיקים. באופן זה נוצרים חלקיקים של תחמוצת המתכת בגדלים שיכולים להגיע ל-5 ננומטר. שיטה זו פשוטה ואינה דורשת מכשור מיוחד.
דרך נוספת ליצירת הננו-חלקיקים בשיקוע היא על ידי הוספת בסיס לתמיסת מלח של יוני המתכת על פי התגובה הבאה (עבור יוני ברזל):
שליטה בגודל ובצורת החלקיקים תלויה בחומרי המוצא, ברמת החומציות, בטמפרטורה, ביחסי היונים ובחוזקם[2][6]. החסרונות בשיטה זו הם שמתקבל טווח גדלים רחב של החלקיקים, המורפולוגיה שלהם אינה אחידה וישנה תלות ב-pH כדי לשלוט בגודל החלקיקים המתקבלים. בנוסף, קשה לצפות את הננו-חלקיקים לאחר הסינתזה בשכבה נוספת עקב היווצרות צברים שלהם.
מנגנון מיצלה הפוכה
[עריכת קוד מקור | עריכה]יצירת מיצלה הפוכה מתבססת על ממס לא פולרי (שאינו מימי), כך שהראש ההידרופילי של המולקולה פונה כלפי ליבת המיצלה והקצוות ההידרופובים פונים כלפי חוץ. במצב זה המרכיבים האי-אורגניים (לדוגמה, ברזל כלורידי) של התגובה ימצאו במרכז המיצלה ושם ייווצרו הננו-חלקיקים.
שיטה זו מאפשרת שליטה טובה על גודל החלקיקים הנוצרים בתוך המיצלה, כך שמתקבלת אחידות בגודלם. כמו כן, ניתן להוסיף שכבת ציפוי מגנה לננו-חלקיקים אלה במהלך הסינתזה.
החיסרון בשיטה הוא שטווח הגדלים של החלקיקים מוגבל לגודל המיצלה ושלא ניתן להוסיף שכבה אורגנית על גבי החלקיקים מאחר שהחומר האורגני יישאר בפאזה של הממס האורגני מבחוץ.
בשיטה זו נוצרו ננו-חלקיקים מגנטיים מקובלט[2][7].
התעבות אדים כימית (CVC)
[עריכת קוד מקור | עריכה]סינתזה של הננו-חלקיקים בעקבות התפרקות תרכובת מתכת נדיפה המחוממת בגז אינרטי (אדיש, שאינו משתתף בתגובה). שיטה זו מאפשרת יצירת ננו-חלקיקים מגנטיים באיכות גבוהה ובכמות גדולה, אך דורשת מכשור מתאים ולעיתים שימוש בתרכובות רעילות מהם מייצרים את החלקיקים[8][9]. בשיטה זו ייצרו ננו-חלקיקים מגנטיים מתכתיים מברזל. הם השתמשו ב כקודמן כך שהוא עבר פירוק בכבשן מחומם ולאחר מכן עיבוי לקבלת הננו-חלקיקים על גבי משטח מקורר. הננו-חלקיקים שהתקבלו היו בטווח גדלים שבין 5 ל-13 ננומטר. ניתן לעשות חמצון נוסף לננו-חלקיקים כפי שבוצע במחקרים אחרים לקבלת ננו-חלקיקים מגנטיים בטווח גדלים של 3–20 ננומטר[10] ו-4–16 ננומטר[11].
פירוק תרמי
[עריכת קוד מקור | עריכה]כאשר תחמוצת מלח מתכתית מחוממת לטמפרטורה מסוימת, היא מתפרקת לננו-חלקיקים של תחמוצת המתכת על פי התגובה הבאה (עבור ברזל)[9][12]:
ניתן לעשות חיזור של אותם ננו-חלקיקים מתחמוצת הברזל לננו-חלקיקים של המתכת עצמה על ידי חימום בטמפרטורה מתאימה ותחת גז מחזר על פי התגובות הבאות:
שיטה זו שכיחה בעיקר בתעשייה.
סינתזת תרסיס להבה
[עריכת קוד מקור | עריכה]סינתזה באמצעות פירוליזה של תרסיס להבה מהווה את אחת השיטות היותר מבטיחות כיום ביצירת ננו-חלקיקים מגנטיים בזכות איכות החלקיקים וטווח גודלם המצומצם[13][14]. שיטה זו מאפשרת הכנת ננו-חלקיקים מגנטיים שקשה או לא ניתן להכין בשיטות אחרות. מהלך הסינתזה כולל הזרקת חומר המוצא כגז או כנוזל וחימומו לטמפרטורה גבוהה הנעה בין 300 ל-500 מעלות צלזיוס, ללא נוכחות חמצן (או כל הלוגן אחר). תהליך זה הוא בלתי הפיך. במהלך התהליך, נוצרים מונומרים של הננו-חלקיקים המתנגשים זה בזה ליצירת אגרגטים לאורך הלהבה כמתואר באיור משמאל. הפרמטרים החשובים בסינתזה הם ריכוז חומר המוצא, זמן השהייה בלהבה והטמפרטורה.
תרסיס להבת הפירוליזה מוקף בצינור עם חורים ומוכנס למתקן עם אטמוספירה אינרטית. שליטה בקצב זרימת הגז מאפשרת תנאים מחזרים. תהליך זה מאפשר סינתזה של ננו-חלקיקים מגנטיים בשלב אחד. באיור מימין מופיעים תנאי סינתזה שונים והשפעתם על סוגי הננו-חלקיקים המתקבלים:
סוגי ננו-חלקיקים מגנטיים
[עריכת קוד מקור | עריכה]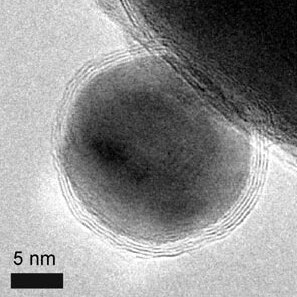
ישנם שלושה סוגי ננו-חלקיקים מגנטיים שמיוצרים כיום:
תחמוצת
[עריכת קוד מקור | עריכה]ננו-חלקיקים אלה עשויים מתחמוצת המתכת והם הננו-חלקיקים המגנטיים הנחקרים ביותר כיום. כאשר ננו-חלקיקים אלה קטנים מ-128 ננומטר הם בעלי פאראמגנטיות על[2], דבר המונע מהם להתאגד מאחר שהם מתמגנטים רק כאשר מושרה עליהם שדה מגנטי חיצוני[15]. לאחר כיבוי השדה החיצוני, הם מאבדים את המגנטיות. ניתן להגביר את היציבות של ננו-חלקיקים אלה בתמיסות באמצעות התאמת פני שטחם על ידי חומרים פעילי שטח, תרכובות סיליקון וחומצה זרחתית[14].
דוגמאות לננו-חלקיקים נפוצים מסוג זה: , .
מתכתיים
[עריכת קוד מקור | עריכה]ננו-חלקיקים מגנטיים ממתכת בלבד הם הפחות מועדפים עקב חסרונותיהם הרבים. ננו-חלקיקים אלה פעילים מאוד ונוטים להגיב באופן ספונטני עם אוויר ומים, כמו כן הם מגיבים עם תחמוצות שונות. תכונה זו מקשה על האחסון, הטיפול והאחזקה של החלקיקים.
מתכתיים עם קליפה
[עריכת קוד מקור | עריכה]ננו-חלקיקים אלה בעלי ליבה מתכתית וקליפת הגנה המאפשרת פסיבציה של פני השטח של החלקיק[2]. דוגמה לננו-חלקיקים עם ליבת קובלט ומעטפת של גרפן מובאת בתמונה[14]. היתרונות בהשוואה לסוגי הננו-חלקיקים המגנטים האחרים הם במגנטיזציה הגבוהה שלהם, ביציבות גבוהה בתמיסות שונות (חומציות, בסיסיות ואורגניות) ובכימיה של מעטפת הגרפן שמוכרת כבר. מחקרים אחרים עשו שימוש בזהב בתור קליפה לננו-חלקיקים[16].
יישומים
[עריכת קוד מקור | עריכה]במגוון רחב של תחומים משתמשים בננו-חלקיקים מגנטיים[2][17][18][19][20], להלן מספר דוגמאות לכך:
אבחון וטיפול רפואי
[עריכת קוד מקור | עריכה]ננו-חלקיקים מגנטיים יכולים לשמש בדימות תהודה מגנטית (MRI) לאבחון רפואי[21][22][23]. תאים המסומנים בננו-חלקיקים מגנטיים הם בעלי זמן רלקסציה (אנ') קצר יותר מאשר תאים ללא החלקיקים, דבר המקנה ניגודיות טובה יותר בהדמיית MRI. בנוסף, ניתן לכוון את הננו-חלקיקים לתאי מטרה ספציפיים בגוף ואף לצמד להם תרופות שיעזרו בטיפול במידת הצורך. באופן זה, הטיפול הוא נקודתי וספציפי לתאי המטרה ולכן יעיל יותר מהטיפול התרופתי הניתן כיום.
במחקר מסוים ייצרו ננו-חלקיקים עם ליבה מתכתית מגנטית ששימשו לטיפול סרטני מוכוון על ידי העברת תרופה לתאים הסרטניים[24]. בנוסף, אותם חלקיקים עזרו באיתור המיקום המדויק של התאים הסרטניים באמצעות דימות MRI כך שניתן לעקוב בזמן אמת אחר הטיפול. בדימות פלואורסצנטי לעומת דימות באמצעות MRI, נהוג להצמיד למעטפת הננו-חלקיקים קבוצות פונקציונליות בעלות יכולת פלואורסצנציה. למרות ששיטה זו שכיחה, הצימוד הפלואורסצנטי למעטפת משפיע על מסיסות החלקיקים ומוריד את מספר האתרים הפנויים לקשירת ליגדנים שהיו יכולים לעזור בהכוונה של אותם ננו-חלקיקים לאתרי המטרה. כמו כן ישנה אפשרות שהחומר המתכתי של הננו-חלקיק יגרום לדעיכת הפליטה הפלואורסצנטית במנגנון דיכוי פלואורסצנטי.
ננו-חלקיקים מגנטיים יכולים להיות מותאמים ביולוגית ומכוונים אל אתר המטרה באמצעות טיפול של פני השטח שלהם, כך שמחד לא יעוררו תגובה חיסונית בגוף ומאידך יכוונו אל תאי המטרה הסרטניים באמצעות קבוצות פונקציונליות על פני מעטפת החלקיק. אחד החומרים המקובלים כיום לציפוי הננו-חלקיקים הוא PEG (אנ')[25] שהוא פולימר אינרטי המונע את הראקטיביות של הננו-חלקיקים ובכך מאפשר להם לפעול בגוף ללא הפרעות. התרופה המיועדת לטיפול נמצאת בתוך מעטפת החלקיק ומופעלת בהגיעה לתא המטרה. הליבה המתכתית מאפשרת לעקוב אחר החלקיקים מרגע כניסתם לגוף ועד הגעתם לגידול באמצעות הדמיית MRI. בנוסף, החלקיקים עשויים מחומרים מתכלים כך שבסוף התהליך הם יתפרקו בגוף ויסולקו ממנו.
כיום ישנו טיפול חדש בשם היפרתרמיה מגנטית[26], בו משתמשים בננו-חלקיקים מגנטיים בטיפול בסרטן בעיקר. הטיפול מתבסס על כך שכאשר חושפים את הננו-חלקיקים המגנטיים לשדה מגנטי מתחלף, הם פולטים חום. כאשר מצמדים את הננו-חלקיקים לגידול בגוף באמצעות קבוצות מתאימות על פני שטח החלקיקים, ומפעילים את השדה המגנטי בתדירות ואמפליטודה מתאימים, טמפרטורת הגידול עולה, מה שגורם למות התאים הסרטניים ללא פגיעה ברקמה הבריאה מסביב.
מחקר ביולוגי ורפואי
[עריכת קוד מקור | עריכה]סימון תאים
[עריכת קוד מקור | עריכה]סימון תאים באמצעות ננו-חלקיקים מגנטיים הוא שיטה מקובלת כיום להפרדת והכוונת תאים[9]. ניתן לסמן את התאים באמצעות חיבור הננו-חלקיקים לשטח התא[27] או באמצעות כניסתם לתא בבליעה תאית (אנדוציטוזה)[28]. ניתן להפרידם או לכוונם בעזרת שדות מגנטיים.
מגנטופיקציה – הדבקה באמצעות שדה מגנטי חיצוני
[עריכת קוד מקור | עריכה]תהליכים של העברת חומרים לתאים באמצעות שדה מגנטי נקראים מגנטופיקציה (אנ'). בתהליך זה קושרים גורם כלשהו אל הננו-חלקיקים המגנטיים ולאחר מכן מוסיפים אותם אל התאים כאשר משרים עליהם שדה מגנטי[29][30]. הננו-חלקיקים נמשכים לתוך התאים בכיוון השדה המושרה. לדוגמה: באמצעות תהליך זה מכניסים רצף של דנ"א לתאים כחלק מתהליך של הנדסה גנטית[31][32].
תהליכי הפרדה
[עריכת קוד מקור | עריכה]אחד השימושים הידועים בננו-חלקיקים מגנטיים בתחום הגנטיקה הוא בידוד מולקולות רנ"א שליח. בשיטה זו קושרים קצה פולי T (רצף בסיסי דנ"א מסוג דאוקסיתימין פוספט) אל פני שטח החלקיק. כאשר מתרחש הערבוב עם הרנ"א שליח, הקצה פולי A (רצף בסיסי דנ"א מסוג דאוקסיאדנין פוספט הנמצאים בקצה של כל רנ"א שליח) של הרנ"א שליח ייצמד לקצה הפולי T המחובר לחלקיק וכך ניתן באמצעות מגנט למשוך את החלקיקים יחד עם מולקולות הרנ"א[33].
כימיה
[עריכת קוד מקור | עריכה]ננו-חלקיקים מגנטיים בעלי פוטנציאל לשמש כזרזים בתגובות כימיות. אפשרות נוספת, מאחר שהחלקיקים מוצקים ובעלי שטח פנים גדול, הם יכולים לשמש כתומכים בזרזים כך שהזרז נספח אל הננו-חלקיקים המגנטיים והם מצדם יכולים להשתתף בתגובה או להיות אינרטים בה[34].
תהליכי טיהור
[עריכת קוד מקור | עריכה]לננו-חלקיקים מגנטיים יש פוטנציאל גבוה לטיפול בזיהומים שונים במים בזכות יכולת ההפרדה שלהם על ידי הפעלת שדה מגנטי ובזכות יחס שטח לנפח גבוה. במחקר עם מתכות כבדות השתמשו בננו-חלקיקים מגנטיים על מנת להרחיק את המתכות הכבדות מתמיסות או ממים מזוהמים[35]. לצורך כך השתמשו בננו-חלקיקים מגנטיים מברזל עם מעטפת פחמנית אליהם צימדו קלאטור EDTA (אנ'). השימוש בננו-חלקיקים עם מעטפת פחמנית מספק מצד אחד יציבות לחלקיק ומאפשר מצד שני לקשור קבוצות פונקציונליות נוספות עליו. לאחר שקשרו אל פני השטח שלהם אינטר-קלאטורים הנקשרים ליוני המתכת, מוסיפים את הננו-חלקיקים המגנטיים אל המים המזוהמים תוך ערבוב טוב, כך שהם קושרים אל פני השטח שלהם את יוני המתכת. בהמשך, פולים את הננו-חלקיקים שנקשרו אל המתכות על ידי ניקוזם באמצעות מגנט.
ליתוגרפיה מגנטית
[עריכת קוד מקור | עריכה]ליתוגרפיה מגנטית (אנ') היא שיטה להדפסה מולקולארית כימית או ביולוגית של פני משטחים הנקראת "מגנטוליתוגרפיה"[36][37][38][39][40][41]. שיטה זו משתמשת באנרגיה של שדות מגנטיים במקום באנרגיית אור. השדה המגנטי נבנה על פני המשטח באמצעות מסכה מגנטית הבנויה ממצע דיאמגנטי (חומר שלא מגיב למגנט) ותבנית העשויה מחומר פרומגנטי (חומר המגיב לשדות מגנטיים). התבנית קובעת את עוצמת השדות המגנטיים על פני המשטח ומטביעה את תבנית המסכה על פני המצע באמצעות ננו-חלקיקים מגנטיים. החלקיקים נמשכים לתבנית השדה המגנטי הנוצר על ידי המסכה המגנטית. הננו-חלקיקים יכולים להיקשר אל פני המשטח וליצור את תבנית המסכה על פני המצע – השיטה הפוזיטיבית – או לחלופין הם חוסמים את ההיקשרות של מולקולות אל פני המצע ובכך יוצרים הדפס מולקולארי שהוא בעצם תשליל המסכה – השיטה הנגטיבית.
אחד היתרונות החשובים של השיטה החדשה הזו לעומת ליתוגרפיה אופטית הוא בכך ששיטה זו אינה רגישה כלל לטופוגרפית פני השטח כמו הפוטוליתוגרפיה. ניתן להדפיס באמצעותה משטחים קעורים או קמורים ואף משטחים סגורים כמו משטחים פנימיים של מיקרו צינוריות. שיטה זו אינה דורשת כיסוי כל שטח המצע בפוטורזיסט (אנ'), דבר הגורם לזיהום פני המשטח ולקשיים בתהליך קשירתם של קבוצות מולקולאריות למצע. לעומת הפוטוליתוגרפיה הדורשת תהליך רב-שלבי הכולל ציפוי, חשיפה ופיתוח, הליתוגרפיה המגנטית היא חד-שלבית, פשוטה וזולה. בשונה מהשיטות האחרות החושפות את המצע כאשר המסכה מעל פני המצע, השיטה המוצעת היא "ליתוגרפיה גבית" כאשר המסכה נמצאת בגב המשטח המודפס. לליתוגרפיה גבית יש יתרון רב בתהליכים בהם תהליכי כיסוי המשטח הם רב-שלביים, כך שכל שכבה חייבת להיות מותאמת עם כל השכבות האחרות.
אחסון מידע
[עריכת קוד מקור | עריכה]ננו-חלקיקים מגנטיים מהווים אופציה יעילה וטובה לאחסון מידע על ידי כך שהם מאפשרים להגדיל את צפיפות המידע המוכנסת ליחידת שטח תוך שמירה על רעש קריאה נמוך[42]. המטרה היא להחליף את האזור המגנטי היחסית גדול הקיים כיום במדיה המשתמשת בקידוד בעזרת ספין מגנטי כגון בדיסקים קשיחים HD, לשימוש בננו-חלקיק מגנטי אחד שהוא בעל מבנה פשוט של התחום המגנטי. אחת הדוגמאות לכך הם ננו-חלקיקים מגנטיים מסגסוגת של ברזל ופלטינה (FePt)[43]. היתרון בננו-חלקיקים אלה שהם לא מאבדים בקלות את המגנטיזציה שהם לאחר הסרת השדה המגנטי החיצוני.
סכנות
[עריכת קוד מקור | עריכה]כיום אין מידע רב לגבי הרעילות והסכנות שיש בננו-חלקיקים. תהליכי הייצור חושפים את האדם והסביבה לננו-חלקיקים. מחקרים מראים כי החלקיקים יכולים להישאף על ידי מערכת הנשימה ולהגיע לאזורים שונים בגוף, כולל המוח[44][45][46].דבר המעיד, ככל הנראה, על מעבר "מחסום דם-מוח" או מעבר דרך האפיתליום האולפקטורי, Olfactory epithelium (אנ'). השאלה בדבר אגירתם של החלקיקים ברקמות הגוף השונות או דרכי פינויים עדיין פתוחה ולא באה לפתרונה המלא.
מחקר על ננו-חלקיקים מגנטיים הראה כי דלעות שגודלו עם מים המכילים את הננו-חלקיקים קלטו אותם לרקמות של הצמח[47]. מכאן, שישנה סכנה מפסולת של ננו-חלקיקים בעת שנפטרים ממנה, היכולה להגיע למי ההשקיה ומשם למזון אותו אנו אוכלים.
סיכון נוסף קיים מהשוני בתכונות החומר כאשר יורדים לרמה הננומטרית והתכונות הפיזיקליות של החומר משתנות לעומת התכונות הקיימות בחומר ברמה המיקרומטרית. כך למשל חומר בממד הננומטרי יכול להיות ריאקטיבי, פלואורסצנטי, מוליך, בעל חוזק רב יותר ואף לקבל תכונות בלתי צפויות[45].
ראו גם
[עריכת קוד מקור | עריכה]- ננו חלקיק
- ננו-חומרים
- ננו-מבנה
- ביוננוטכנולוגיה
- ננו טוקסיקולוגיה
- מגנוט
- מומנט מגנטי
- בדיקת חלקיקים מגנטיים
קישורים חיצוניים
[עריכת קוד מקור | עריכה]הערות שוליים
[עריכת קוד מקור | עריכה]- ^ Kittel C. and Galt K. (1956). Solid State Physics. 3, 439.
- ^ 1 2 3 4 5 6 7 Lu A. H., Salabas E. L.,Schuth F. (2007). "Magnetic nanoparticles: synthesis, protection, functionalization, and application". Angewandte Chemie 46:1222-1244. http://dx.doi.org/10.1002/anie.200602866. PMID 17278160.
- ^ Thomas J. R. (1966). "Preparation and Magnetic Properties of Colloidal Cobalt Particles". Journal of Applied Physics 37:2914. http://dx.doi.org/10.1063/1.1782154
- ^ Senyei A., Widder K. and Czerlinski C. (1978). "Magnetic guidance of drug carrying microspheres". Journal of Applied Physics 49:3578-3583.
- ^ Widder K. J., Senyel A. E. and Scarpelli G. D.(1978). " Magnetic microspheres: a model system of site specific drug delivery in vivo". Proceedings of The Society for Experimental Biology and Medicine 158:141-146. PMID 674215.
- ^ Fang M., Strom V., Olsson R. T., Belova L. and Rao K. V. (2011). "Rapid mixing: A route to synthesize magnetite nanoparticles with high moment". Applied Physics Letters 99: 222501. http://dx.doi.org/10.1063/1.3662965.
- ^ Rana S. S. and Philip B. R. (2010). "Micelle based synthesis of Cobalt Ferrite nanoparticles and its characterization using Fourier Transform Infrared Transmission Spectrometry and Thermogravimetry". Materials Chemistry and Physics 124:264-269. http://dx.doi.org/10.1016/j.matchemphys.2010.06.029.
- ^ Choi C. J., Dong X. L. and Kim B. K. (2001). "Microstructure and magnetic properties of Fe nanoparticles synthesized by chemical vapor condensation". Materials Transactions 42:2046-2049.
- ^ 1 2 3 McBain S. C., Yiu H. H. and Dobson J. (2008). "Magnetic nanoparticles for gene and drug delivery". International Journal of Nanomedicine 3:169-180 . http://dx.doi.org/10.2147/IJN.S1608. PMID 18686777.
- ^ Sun S. and Zeng H. (2002). “Size-controlled synthesis of magnetite nanoparticles”. Journal of the American Chemical Society 124(28):8204-8205. http://dx.doi.org/10.1021/ja026501x. PMID 12105897.
- ^ Hyeon T. et al. (2002). “Synthesis of Highly Crystalline and Monodisperse Cobalt Ferrite Nanocrystals”. Journal of Physical Chemistry 106(27):6831-6833. http://dx.doi.org/10.1021/jp026042m.
- ^ Nurmi J. T. et al. (2005). "Characterization and properties of metallic iron nanoparticles: spectroscopy, electrochemistry, and kinetics". Environmental Science & Technology 39: 1221-1230. http://dx.doi.org/10.1021/es049190u. PMID 15787360.
- ^ Athanassiou E. K., Grass R. N. and Stark W. J. (2010). "Chemical Aerosol Engineering as a Novel Tool for Material Science: From Oxides to Salt and Metal Nanoparticles". Aerosol Science and Technology 44:161-172. http://dx.doi.org/10.1080/02786820903449665.
- ^ 1 2 3 Grass R. N. and Stark W. J. (2006). "Gas phase synthesis of fcc-cobalt nanoparticles". Journal of Materials Chemistry 16:1825-1830. http://dx.doi.org/10.1039/B601013J.
- ^ Ruiz-Herna´ndez, E., Lo´pez-Noriega, A., Arcos, D. and Vallet-Regı´, M. (2008). "Mesoporous magnetic microspheres for drug targeting". Solid State Sciences 10:421-426. http://dx.doi.org/10.1016/j.solidstatesciences.2007.11.026.
- ^ Johnson S. H. et al. (2010). “Co@CoO@Au core-multi-hell nanocrystals”. Journal of Materials Chemistry 20(3):439. http://dx.doi.org/10.1039/b919610b.
- ^ Tartaj P., Morales M. P., Veintemillas-Verdaguer S., Gonz´alez-Carre˜no T. and Serna C. J. (2003). "The preparation of magnetic nanoparticles for applications in biomedicine". Journal of Physics D: Applied Physics 36:R182-R197. http://dx.doi.org/10.1088/0022-3727/36/13/202.
- ^ Reddy L. H., Arias J. L., Nicolas J. and Couvreur P. (2012). "Magnetic nanoparticles: design and characterization, toxicity and biocompatibility, pharmaceutical and biomedical applications". Chemical Reviews 112:5818-5878. http://dx.doi.org/10.1021/cr300068p. PMID 23043508.
- ^ Akbarzadeh A., Samiei M. and Davaran S. (2012). "Magnetic nanoparticles: preparation, physical properties, and applications in biomedicine". Nanoscale Research Letters 7:144. http://dx.doi.org/10.1186/1556-276X-7-144. PMID 22348683.
- ^ Li L. et al. (2006). "Synthesis, Properties, and Environmental Applications of Nanoscale Iron-Based Materials: A Review". Critical Reviews in Enviromental Science and Technology 36:405-431 . http://dx.doi.org/10.1080/10643380600620387.
- ^ Hadjipanayis C. G. et al.(2008). "Metallic iron nanoparticles for MRI contrast enhancement and local hyperthermia". Small 4:1925-1929. http://dx.doi.org/10.1002/smll.200800261. PMID 18752211.
- ^ Lu C. W. et al. (2007). “Bifunctional Magnetic Silica Nanoparticles for Highly Efficient Human Stem Cell Labeling”. Nano Letters 7(1):149-154. http://dx.doi.org/10.1021/nl0624263. PMID 17212455.
- ^ Pankhurst Q. A., Connolly J., Jones S. K. and Dobson J. (2003). "Applications of magnetic nanoparticles in biomedicine". Journal of Physics D: Applied Physics 36:R167-R181. http://dx.doi.org/10.1088/0022-3727/36/13/201.
- ^ Santra S., Kaittanis C., Grimm J. and Perez J. M. (2009). "Drug/dye-loaded, multifunctional iron oxide nanoparticles for combined targeted cancer therapy and dual optical/magnetic resonance imaging". Small 5:1862-1868. http://dx.doi.org/10.1002/smll.200900389. PMID 19384879.
- ^ Zhang Y., Kohler N. and Zhang M. (2002). "Surface modification of superparamagnetic magnetite nanoparticles and their intracellular uptake". Biomaterials 23:1553-1561. http://dx.doi.org/10.1016/S0142-9612(01)00267-8. PMID 11922461.
- ^ Rabias I. et al. (2010). Biomicrofluidics 4:024111. http://dx.doi.org/10.1063/1.3449089
- ^ Tada D. B. et al. (2007). "Methylene blue-containing silica-coated magnetic particles: a potential magnetic carrier for photodynamic therapy". Langmuir 23:8194-8199. http://dx.doi.org/10.1021/la700883y. PMID 17590032.
- ^ Bi S., Wei X., Li N. and Lei Z. (2008). "In-situ formation of Fe3O4 nanoparticles within the thermosensitive hairy hybrid particles". Materials Letters 62:2963-2966. http://dx.doi.org/10.1016/j.matlet.2008.01.084.
- ^ Plank c. et al. (2003). "The magnetofection method: using magnetic force to enhance gene delivery". Biological Chemistry 384(5):737-747. http://dx.doi.org/10.1515/BC.2003.082. PMID 12817470.
- ^ Scherer F. et al (2002). "Magnetofection: enhancing and targeting gene delivery by magnetic force in vitro and in vivo". Gene Therapy. 9 (2): 102–109. http://dx.doi.org/10.1038/sj.gt.3301624. PMID 11857068.
- ^ Morishita N. et al. (2005). "Magnetic nanoparticles with surface modification enhanced gene delivery of HVJ-E vector". Biochemical and Biophysical Research Communications 334:1121-1126. http://dx.doi.org/10.1016/j.bbrc.2005.06.204. PMID 16134237.
- ^ Plank C., Anton M., Rudolph C., Rosenecker J., Krötz F. (2003). "Enhancing and targeting nucleic acid delivery by magnetic force". Expert Opinion on Biological Therapy 3 (5): 745–758. http://dx.doi.org/10.1517/14712598.3.5.745.
- ^ Sarkar T. R. and Irudayaraj J. (2008). "Carboxyl-coated magnetic nanoparticles for mRNA isolation and extraction of supercoiled plasmid DNA". Analytical Biochemistry 379:130-132. http://dx.doi.org/10.1016/j.ab.2008.04.016. PMID 18471426.
- ^ Schätz A., Reiser O., Stark W. J. (2010). “Nanoparticles as Semi-Heterogeneous Catalyst Supports”. Chemistry – A European Journal 16(30):8950-8967. http://dx.doi.org/10.1002/chem.200903462. PMID 20645330.
- ^ Koehler F. M. et al. (2009). "Magnetic EDTA: coupling heavy metal chelators to metal nanomagnets for rapid removal of cadmium, lead and copper from contaminated water". Chemical Communications 32:4862-4864. http://dx.doi.org/10.1039/b909447d. PMID 19652806.
- ^ Bardea A. and Naaman R.(2010).″Magnetolithography: From Bottom-Up Route to High Throughput″. Advances in Imaging and Electron Physics, Volume 164, Chapter 1:1-27
- ^ Kumar T. A., Bardea A., Shai Y., Yoffe A. and Naaman R.(2010). ″Patterning Gradient Properties from Sub-Micrometers to Millimeters by Magnetolithography″. Nano Letters10:2262-2267. http://dx.doi.org/10.1021/nl1013635.
- ^ Bardea A., Baram A., Kumar T. A. and Naaman R.(2009). ″Magnetolithographic patterning of inner walls of a tube: A new dimension in micro fluidics and sequential microreactors″. Journal of the American Chemical Society 131:18260-18262. http://dx.doi.org/10.1021/ja908675c. PMID 19961172
- ^ Bardea A. and Naaman R. (2009). ″Submicrometer Chemical Patterning with high Throughput Using Magnetolithography". Langemiur25:5451-5454. http://dx.doi.org/10.1021/la900601w. PMID 19382781.
- ^ Bardea A. and Naaman R. (2009). "Magnetolithography: From Bottom-Up Route to High Throughput". Small 5:316-319. http://dx.doi.org/10.1002/smll.200801058. PMID 19123174
- ^ Bardea A., Burshtein N., Rudich Y., Salame T., Ziv C., Yarden O. and Naaman R. (2011). "Sensitive detection and identification of DNA and RNA using a patterned capillary tube".Annalytical Chemistry 83:9418-9423. http://dx.doi.org/10.1021/ac202480w. PMID 22039991.
- ^ Frey N. A. and Sun S. Magnetic Nanoparticle for Information Storage Applications
- ^ Sun S., Murray C. B., Weller D., Folks L., Moser A. (2000). " Monodisperse FePt Nanoparticles and Ferromagnetic FePt Nanocrystal Superlattices". Science 287:1989-1992. http://dx.doi.org/10.1126/science.287.5460.1989.
- ^ Oberdorster G., Oberdorster E. and Oberdorster J. (2005)."Nanotoxicology: an emerging discipline evolving from studies of ultrafine particles". Environmental Health Perspectives 113(7):823-839. http://dx.doi.org/10.1289/ehp.7339. PMID 16002369.
- ^ 1 2 Hallock M. F., Greenley P., DiBerardinis L. and Kallin D. (2008). "Potential risks of nanomaterials and how to safely handle materials of uncertain toxicity". Journal of Chemical Health and Saftey 16(1):16-23. http://dx.doi.org/10.1016/j.jchas.2008.04.001.
- ^ Oberdörster G. et al. (2004). "Translocation of inhaled ultrafine particles to the brain". Inhalation Toxicology 16:437-445. PMID 15204759.
- ^ Zhu H., Han J., Xiao J. Q. and Jin Y. (2008). "Uptake, translocation, and accumulation of manufactured iron oxide nanoparticles by pumpkin plants". Journal of Environmental Monitoring 10:713-717. http://dx.doi.org/10.1039/b805998e. PMID 18528537.








