נוירוגנזה
 | |
| שיוך |
nervous system development |
|---|---|
| מזהים | |
| קוד MeSH |
G04.152.912 |
| מזהה MeSH |
D055495 |
| מערכת השפה הרפואית המאוחדת |
C0814002 |
נוירוגנזה (Neurogenesis - לידת תאי עצב) הוא התהליך שבו נוצרים תאי עצב חדשים מתוך תאי גזע. היצירה של תאי עצב מתרחשת בעיקר בזמן התפתחות העובר, כאשר בניגוד למרבית התאים בגוף, תאי עצב בוגרים אינם עוברים חלוקה תאית. במשך שנים רבות האמינו כי במהלך החיים לא נוצרים תאי עצב חדשים כלל, אך כיום ידוע כי תהליך של נוירוגנזה מתרחש בצורה מוגבלת גם במוח הבוגר. עד היום נמצאו עדויות לתהליך זה רק בשני אזורים במוחות של יונקים: בהיפוקמפוס ובפקעת הריח (Olfactory Bulb)[1]. נכון להיום, אין עדויות לנוירוגנזה בקליפת המוח האנושית[2].
תהליך הנוירוגנזה מווסת על ידי חלבון בשם גורם נוירוטרופי מוחי (BDNF) הממלא תפקיד מפתח ביצירת נוירונים חדשים, מבטיח את הישרדותם ובה בעת מעודד ייצור סינפסות – תהליך חיוני לחשיבה, למידה, ורמות גבוהות יותר של תפקוד מוחי[3].
היסטוריה
[עריכת קוד מקור | עריכה]במחצית הראשונה של המאה ה-20, אחת התאוריות העיקריות הייתה כי כלל הנוירונים נוצרו במהלך התפתחות העובר ובחיים המוקדמים שלאחר הלידה. במוח הבוגר, תהליך הנוירוגנזה לא נחשב כקיים. בשנת 1965 התפרסם מאמרו של ג׳וזף אלטמן[4] שטען לעדויות לתאי עצב חדשים במוח בוגר של חולדות[5]. מאמרו של אלטמן נדחה על ידי הקהילה המדעית ולבסוף נתקבל בעקבות מחקר על נוירוגנזה אצל ציפורי שיר.[1] רעיון התחדשות הנוירונים במוח סלל את הדרך לשיטות טיפול חדשות שנועדו לשנות את חייהם של הסובלים מפגיעות או מחלות מוח קשות[3].
נוירוגנזה לאורך החיים
[עריכת קוד מקור | עריכה]נוירוגנזה בעוברות
[עריכת קוד מקור | עריכה]בשלב העוברות, מרגע שנסגר צינור העצבים, מתחיל תהליך המורכב ממספר שלבים הכרחיים להתפתחות מערכת עצבים תקינה. בשלב הראשון, שלב הנוירוגנזה, הגוף מייצר את חומר הגלם ממנו תתפתח מערכת העצבים. תהליך זה מתרחש ב"אזור החדרי" (ventricular zone) שבהמשך יהפוך לחדרי המוח. לתהליך שני שלבי חלוקה: 1. שלב החלוקה הסימטרית- תאי האקטודרם מתחלקים לשני תאי אב זהים. למעשה, זהו תהליך הגדילה במערכת העצבים שנמשך כשבועיים, שלושה עד שישנה כמות מספקת של תאי אב. 2. שלב החלוקה הא-סימטרית- כל תא אב מתחלק לתא אב ולנוירון או לתא גליה, זהו תהליך של התמיינות. התהליך נמשך כמה שבועות עד שיש מספיק נוירונים ותאי גליה מהם אפשר ליצור את מערכת העצבים. בבני אדם, שלב החלוקה הא-סימטרית הוא ארוך במיוחד בהשוואה לבעלי חיים אחרים, דבר המסביר למה אזור הקורטקס שלנו גדול יותר ביחס לבעלי חיים אחרים. בסיומו של התהליך נשארים עם מאגר תאי אב. חלקם מתים וחלק קטן מהם נשאר במוח כתאי אב המאפשרים נוירוגנזה גם במוח הבוגר[6].
נוירוגנזה במוח הבוגר
[עריכת קוד מקור | עריכה]שנים רבות האמינו כי תהליך הנוירוגנזה הושלם בלידה של יונקים. היוצא מן הכלל היו נוירונים המקושרים לחוש הריח. את ההצעה הראשונה כי נוירוגנזה עשויה להתרחש בבעלי חיים בוגרים העלו ברנע ונוטבום ב-1994, שגילו כי אצל ציפורי שיר יש היווצרות של נוירונים חדשים בזמן למידת שירים. בשנת 1999, החוקרת אליזבת גולד ועמיתיה הראו כי לא רק שנוירונים חדשים מיוצרים בקופים בוגרים מסוג רזוס (Rhesus), אלא שהם נודדים להיפוקמפוס ולאזורים בקורטקס. ממצאים דומים במוח האנושי דווחו על ידי גייג' (Gage) בשנת 2000[6]. אף על פי שמספר הנוירונים המתחדשים במוח הבוגר קטן בהשוואה לנוירוגנזה בעוברות, הם עשויים לשחק תפקיד חשוב מאוד בהסתגלות המוח בתגובה לניסיון חיים[6].
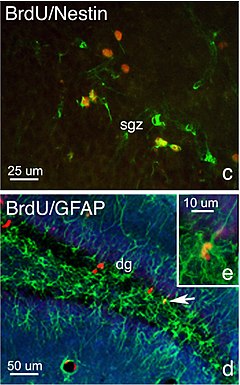
ניסויים הדגימו כי בקרב יונקים, נוירוגנזה מתרחשת בבגרות בעיקר בשני אזורים של מערכת העצבים, בחלק הקדמי של אזור ה-SVZ לאורך החדרים הרוחביים, ובאזור ה-SGZ של ה-Dentate Gyrus בהיפוקמפוס. אזורים אלו מכילים תאי גזע עצביים בעלי פוטנציאל להתפתח לסוגי תאים שונים. נוירונים שנוצרו באזור ה-SVZ וטרם התמיינו, נודדים לפקעת ההרחה, שם הם מתמיינים לאינטר-נוירונים מקומיים. אף על פי שבכל יום נולדים אלפי נוירונים חדשים באזורים אלו, רק מיעוט מתוכם שורד ורוכש יכולות של נוירונים בוגרים[7].
נוירוגנזה ולמידה וזיכרון
[עריכת קוד מקור | עריכה]היפוקמפוס
[עריכת קוד מקור | עריכה]ישנה הערכה כי בהיפוקמפוס אלפי תאים חדשים נוצרים בכל יום באזור התת-גרעיני (Subgranular zone). עם זאת, מספר ימים לאחר היווצרותם לפחות חצי מהם מתים. התאים שנשארים עוברים דרך מספר שלבי התמיינות כך שבסופו של דבר הופכים לנוירונים בוגרים באזור הספציפי שלהם[7].
מזה זמן רב ידוע שההיפוקמפוס חשוב ללמידה ולזיכרון, וכן למצבי רוח ולרגשות. לאחרונה נמצא כי זהו אחד המבנים הייחודיים במוח הבוגר בו יכולים להיווצר תאי עצב חדשים. ההנחה היא שהמוח האנושי מייצר כ-700 תאי עצב חדשים ביום בהיפוקמפוס, וכי עד גיל 50 כל תאי העצב בהיפוקמפוס איתם נולדנו, יוחלפו בחדשים.
מעדויות מחקריות, ניתן לראות שאם חוסמים את יכולתו של המוח הבוגר לייצר תאי עצב חדשים בהיפוקמפוס אזי חוסמים גם חלק מיכולות הזיכרון. תאי העצב חשובים לא רק לנפח הזיכרון, אלא גם לאיכותו. כלומר, הם מסייעים בהבחנה בין זיכרונות דומים[8].
מנקודת מבט תפקודית, נוירוגנזה במערכת העצבים, ובאופן ספציפי יותר- נוירוגנזה בהיפוקמפוס, היא תהליך בעל תפקיד חשוב בפלסטיות מבנית ותחזוקה רשתית[7].
קונסולידציה
[עריכת קוד מקור | עריכה]תהליך הקונסולידציה הוא תהליך אחסון מידע במוח. תהליך זה מתאפשר בזכות הפלסטיסיות (הגמישות) של המוח ובזכות הנוירוגנזה[6]. כאשר מתרחשת למידה, המידע נכנס למערכת דרך החושים, תהליך המאפשר למידע להישמר במערכת. התהליך מתרחש ברובו בהיפוקמפוס ומורכב משני שלבים: השלב הראשון והמהיר יותר מתרחש בעת הלמידה והשלב השני מתרחש בזמן שנת הלילה. לא כל המידע שנקלט במהלך היום עובר את התהליך, אלא רק מידע שהפנינו אליו קשב[6]. ההיפוקמפוס מהווה 'אינדקס' למידע שנמצא ברשת הסמנטית באונות הטמפורליות. במהלך השינה, ההיפוקמפוס מפעיל את הרשת בין האינדקס לאזור הרלוונטי בקורטקס, וכך נוצרים קשרים באותו אזור. הפעלה חוזרת ונשנית של אותה רשת לבסוף תוביל לייצוג השלם של הזיכרון בקורטקס עצמו, ולניתוק הקשר בין ההיפוקמפוס לקורטקס. תהליך זה של שחזור הלמידה, המתרחש שוב ושוב בלילה, נקרא "רה-אקטיבציה"[6]. לאחר שהקשרים החדשים חזקים מספיק, המידע נשמר בקורטקס וההיפוקמפוס יוצא מהתמונה ומתפנה למידע חדש. למעשה, בזמן השינה, ההיפוקמפוס בוחר איזו רשת להפעיל מספר רב של פעמים עד ליצירת קשרים באזור הרלוונטי בקורטקס כך שבפעם הבאה שניתקל באותו הגירוי, יופעלו הנוירונים באזור המוחי הרלוונטי (ולא בהיפוקמפוס). תהליך זה מתרחש ימים או שבועות. כל עוד לא התרחשה שנת לילה, המידע החדש נמצא בהיפוקמפוס והוא אינו יציב ויכול להתערבב עם מידע אחר[5].
נוירוגנזה ופלסטיות מוחית
[עריכת קוד מקור | עריכה]פלסטיות (גמישות) מוחית היא יכולתו של המוח להשתנות בעקבות אינטראקציה עם הסביבה; כלומר, במפגש עם גירויים מעולמינו הפנימי (רגשות, זיכרונות וכו') או החיצוני (סביבת לימודים או עבודה). השינויים מתרחשים בעקבות שחרור מוגבר של נוירוטרנסמיטורים, הימצאות של יותר רצפטורים, התהוות חיבור חדש בין דנדריט לאקסון אשר לא היה קיים קודם וחיזוק של קשרים קיימים. שינויים אלו מהווים ביטוי לתהליך של למידה[5]. אחד המנגנונים המאפשרים למוח את הפלסטיות המוחית הוא הנוירוגנזה, וספציפית נוירוגנזה בהיפוקמפוס הבוגר[6]. בהיפוקמפוס נמצאים תאים מיוחדים והשינויים אשר נוצרים בהם מאפשרים למידת מידע חדש במהירות. כמו כן, הסינפסות בהיפוקמפוס גמישות, ניתן לשנות אותן, לחזק את הקשרים ביניהן ואת השפעת הנוירונים שבהן וכך מתאפשר תהליך הלמידה[6].
נוירוגנזה ומחלות
[עריכת קוד מקור | עריכה]פרקינסון
[עריכת קוד מקור | עריכה]מחלת פרקינסון היא מחלה נוירו-דגנרטיבית המתקדמת באיטיות ומאופיינת בהפרעות מוטוריות טיפוסיות. אף על פי שאבחון המחלה מבוסס על סימפטומים מוטוריים, בשנים האחרונות נמצא כי מחלת פרקינסון מקושרת לסימפטומים כגון דיכאון וחרדה, שאינם מקושרים באופן ישיר עם תהליכים נוירו-דגנרטיביים בחומר השחור (substantia nigra), אלא עשויים להישען על תהליכים תפקודיים שונים הקשורים לליקויים בנוירוגנזה במוח הבוגר. במודלים של חיות ומחקרים שלאחר המוות במחלת פרקינסון נראה כי נוירוגנזה במוח הבוגר נפגעת באופן משמעותי, אם כי המנגנונים והשפעותיהם של פגיעות אלו אינם מובנים במלואם. נכון להיום, ניתוחים שלאחר המוות הבוחנים את תהליך הנוירוגנזה במוח הבוגר בחולי פרקינסון הם מוגבלים. מחקר מפורט ומקיף על התפשטותם והישרדותם של תאי גזע עצביים בוגרים בחולי פרקינסון עדיין לוקה בחסר וכתוצאה מכך מקשה על היכולת בקבלת תוצאות חד משמעיות. יתרה מכן, הקושי לשמר רקמות בני-אדם לאחר המוות ותהליכים מוחיים נוספים, מהווים אזהרות משמעותיות להשגת תוצאות אמינות לנוירוגנזה במוח הבוגר בחולי פרקינסון[9].
אלצהיימר
[עריכת קוד מקור | עריכה]מחלת אלצהיימר היא מחלה נוירו-דגנרטיבית המקושרת עם הזדקנות ומובילה לדמנציה וירידה בתפקודים קוגניטיביים ורגשיים[7]. ההשלכות הרציניות ביותר של מחלת אלצהיימר הן חוסר היכולת לבצע ולהשתמש בזיכרונות. עם זאת, במחקר שנערך בשנים האחרונות, הבחינו בהיווצרות נוירונים חדשים בהיפוקמפוס במוחות שהתקבלו מחולים עם מחלת אלצהיימר. במחקר זה, בזמן המוות של מטופלים עם דמנציה חמורה, הייתה היווצרות מוגברת של נוירונים צעירים (immature) שנצפתה ב-Dentate gyrus|Dentate Gyrus של ההיפוקמפוס, אזור מוחי בו רובם המכריע של נוירונים חדשים מופיעים, מתרבים ומתגוררים. מחלת אלצהיימר מאופיינת באובדן נוירונים, הופעת קשרים נוירופיברילרים וגושים הנקראים "פלאקים עמילואידיים" באזורי מוח הכוללים את ההשתנות ההיפוקמפלית ופקעת ההרחה, שהם אזורים במוח בהם נוירוגנזה מצויה ביותר. במחלת אלצהיימר נצפה לראות ירידה בהתפשטות נוירונלית, במיוחד באזורים היפוקמפלים, בהם מתרחשות ההשפעות ההרסניות ביותר של המחלה. עם זאת, בשנים האחרונות, דיווחים שונים הצביעו על עליה בהתפשטות. בשנות ה-90, דיווחו כי פגיעה בחולדות בקורטקס האנטורינלי, הגבירה באופן משמעותי את התפשטות הנוירונים החדשים בהיפוקמפוס. הקורטקס האנטורינלי הוא האזור המוחי הנפגע ביותר במהלך ההתקדמות המוקדמת של אלצהיימר. הוא אינו ידוע בפוטנציאל ההתחדשות שלו, אך הוא מספק את האינפוט הראשוני ל-Dentate Gyrus. בנוסף, נמצא גם כי נוירוגנזה בDentate Gyrus- של ההיפוקמפוס מוגברת על ידי מוות של נוירוני גרנולה באזור זה של המוח. מתוך כך ניתן להסיק כי עליה בייצור נוירונים חדשים בסובלים ממחלת אלצהיימר, ייתכן ונובעת מהרס של תאי עצב באזורים קורטיקליים, או ממוות תאי ב-Dentate Gyrus עצמו[10].
גורמים סביבתיים המשפיעים על נוירוגנזה
[עריכת קוד מקור | עריכה]מוכרים מספר גורמים המשפיעים על ייצור גורם נוירוטיפי מוחי, BDNF, ובכך משפיעים על תהליך הנוירוגנזה במוח. הגן המפעיל את ה-BDNF מונע על ידי מגוון הרגלים כמו פעילות גופנית ותזונה[3].
נוירוגנזה ותזונה – חיזוק והחלשת תהליך הנוירוגנזה במוח הבוגר
[עריכת קוד מקור | עריכה]לתזונה ישנה השפעה עיקרית על ייצור תאי עצב חדשים בהיפוקמפוס. מספר גורמים הוכחו כמועילים, ביניהם: הגבלת קלוריות, מרווחים ארוכים יותר בין ארוחות, צריכה של פלבנואידים (הנמצאים בשוקולד מריר או באוכמניות), דיאטה קֶטוגנית (עתירת שומן ודלת פחמימות) וצריכה של חומצות שומן מסוג אומגה 3 (הנמצאות בדגים שומניים כמו סלמון) וכורכום. כל אלו יגבירו את ייצור תאי העצב החדשים[3]. לעומת זאת, תזונה עשירה בשומן רווי וצריכת אלכוהול ישפיעו לרעה על הנוירוגנזה. מרקם האוכל גם כן נמצא כמשפיע; מזונות רכים פוגעים בנוירוגנזה בעוד מזון הדורש לעיסה, גריסה וטחינה מגביר את התהליך[3]. במחקרים בבני אדם התגלה כי תזונה מווסתת זיכרון ומצבי רוח באותו האופן בו היא מווסתת נוירוגנזה. לדוגמה: באותה המידה שהגבלה קלורית (20-30% פחות מהצריכה המקובלת) תשפר קיבולת זיכרון, כך היא תעודד נוירוגנזה, ואילו תזונה עשירה בשומן, תחמיר סימני דיכאון ובאותו האופן תפגע בנוירוגנזה. בניגוד לכך, חומצות שומן מסוג אומגה 3, מגבירות נוירוגנזה וגם מסייעות בהפחתת סימני דיכאון. לכן, יש להניח כי ההשפעה של התזונה על בריאות הנפש, על הזיכרון וכן על מצב הרוח, מתאפשרת על ידי היווצרות תאי עצב חדשים בהיפוקמפוס וזה לא מסתכם רק בסוג המזון, אלא גם במרקמו, כמותו ומועד האכילה[3].
הגבלת קלוריות
[עריכת קוד מקור | עריכה]גורם אפיגנטי המפעיל את הגן האחראי על ה-BDNF הוא הגבלת קלוריות (20-30% פחות). בהגבלה זו, ייצור ה-BDNF במוח מזנק וחל שיפור ניכר בזיכרון וכישורים קוגניטיביים אחרים. כיום, שפע של ניסויים בבני אדם מציגים את השפעתה העצומה של צריכת קלוריות מופחתת על תפקוד המוח[3]. הגבלת קלוריות מספקת הגנה עצבית עמוקה, מעודדת צמיחה של תאי מוח חדשים ומאפשרת לקשרים עצביים קיימים להרחיב את השפעתם (משמע, גמישות מוחית)[3].
נוירוגנזה ופעילות גופנית
[עריכת קוד מקור | עריכה]פעילות גופנית היא אחת הדרכים המשמעותיות ביותר לשנות את הגנים, ובמיוחד אימון אירובי. אימון אירובי הוכח כמגביר את ייצור ה-BDNF, משקם ירידה בזיכרון אצל קשישים ומעודד צמיחה של תאים חדשים במרכז הזיכרון של המוח[3]. זאת ועוד, לאחר פעילות גופנית, הגוף מייצר טסטוסטרון באופן מוגבר והוא כשלעצמו מועיל בייצור תאים עצביים חדשים.
במחקר שנערך על ידי גייג' נבחנו שני עכברים; לאחד היה גלגל ריצה בכלוב ולשני לא. החוקרים הבחינו בעלייה עצומה בתאי עצב חדשים בהיפוקמפוס של העכבר עם גלגל הריצה[8].
נוירוגנזה וחסך בשינה
[עריכת קוד מקור | עריכה]שינה של 6–8 שעות עשויה להגביר את תהליך הנוירוגנזה במוח. בזמן השינה מתרחש תהליך של הסרת פסולת כתוצר לוואי של המוח. תהליך זה הכרחי לתפקוד האופרטיבי של יצירת תאי מוח חדשים. לעומת זאת, שינה מופחתת תשפיע לרעה על הנוירוגנזה. כפי שהוזכר, לשנת לילה תפקיד קריטי בתהליך של למידה. עובדה זו מסבירה מדוע אימהות לתינוקות בשלבים מוקדמים נאבקות בזיכרון[8].
נוירוגנזה ודיכאון
[עריכת קוד מקור | עריכה]אחת התצפיות שהובילה להתמקדות בנוירוגנזה בהיפוקמפוס הבוגר בזמן דיכאון, הראתה כי רוב התרופות האנטי-דיכאוניות וההתערבויות הסביבתיות, המאפשרות התנהגות שאינה דיכאונית, מעוררות נוירוגנזה במוח הבוגר בהיפוקמפוס. משך זמן ההבשלה של נוירונים חדשים ב-Dentate Gyrus והתכונות הפיזיולוגיות הייחודיות של נוירונים מסוימים שזה עתה נולדו, מאפשרים נוירוגנזה בהיפוקמפוס במוח הבוגר כמנגנון פוטנציאלי הנמצא בבסיס פעילות שאינה דיכאונית[11]. מספר מחקרים שהראו כי נוירוגנזה הכרחית להשפעות של תרופות נוגדות דיכאון (כגון: אימפירמין ופלוקסוטין) בעכברים, מהווים ראיות משכנעות ביותר המקשרות נוירוגנזה בהיפוקמפוס הבוגר עם תרופות אנטי דיכאוניות. בנוסף, בחולדות, הקנבינואיד הסינתטי (HU210) הוא בעל השפעות של התנהגות שאינה דיכאונית ותלוי גם הוא בנוירוגנזה. ההשפעות ההתנהגויות של פלוקסוטין (תרופה אנטי-דיכאונית) בחולדות הנאמד במבחן ״השחייה-הכפויה״, גם כן דרשו נוירוגנזה כדי ליצור השפעה אנטי-דיכאונית[11].
בין היתר, תלותן של ההשפעות ההתנהגותיות הנובעות מתרופות נוגדות דיכאון בנוירוגנזה עשויה להיות מעוצבת על ידי מספר גורמים כולל ההרכב הגנטי של האורגניזם ואופיים של נוגדי הדיכאון[11].
נוירוגנזה ולחץ
[עריכת קוד מקור | עריכה]בבני אדם, גורמי לחץ מוקדמים בחיים הם בין הגורמים המרכזיים לדיכאון מז׳ורי בחיים המאוחרים. חוויות קשות בתוך הרחם או בתקופה הנאונטלית (החודש הראשון בחיי התינוק), כמו פרידה מוקדמת מהאם או התעללות, יכולות להוביל לפעילות ציר ה-HPA באופן ממושך ולשינויים לאורך זמן בתגובת הלחץ; אשר בתורם עלולים להשפיע על אינדיבידואלים בהתפרצות דיכאון בבגרות, הפרעת חרדה או שתיהן. בתנאי ניסוי נמצא כי חשיפת בעלי חיים בהריון ללחץ משפיעה על תקופות קריטיות של התפתחות המוח העוברי, שעלולה לשנות בהתמדה את הפרמטרים המבניים, הרגשיים והנוירואנדוקריניים אצל הצאצאים ולהוביל להתנהגות דמוית חרדה, עליה בתגובתיות ציר ה-HPA וקשיי זיכרון בחיים הבוגרים. חשיפת חולדות בהריון או יונקים אחרים ללחץ גורמת להפחתה מתמשכת של נוירוגנזה במוח הבוגר בצאצאים. חסך אימהי או רמות נמוכות של טיפול אימהי מפחיתים נוירוגנזה בהיפוקמפוס בחלק מהמחקרים שנעשו[12].
נוירוגנזה והשתלת תאי גזע עובריים
[עריכת קוד מקור | עריכה]תאי גזע עובריים (Embryonic stem cells) מופקים מעוברים צעירים מאוד. אלו הם תאים המסוגלים להתמיין לכלל תאי הגוף[13]. ניתן לייצר תאי גזע עובריים מכלל היונקים ולגדלם בתרבית ללא הגבלת זמן, תוך שמירה על קריוטיפ תקין וטוטיפוטנטיות[13]. בשנים האחרונות נמצא שניתן לכוון תאי גזע עובריים אנושיים בתרבית לתאי-אב נויראליים באופן שמחקה את ההתפתחות העוברית, ממצא המחזק את הגישה המעודדת שימוש בתאים אלה לצורך השתלה בחולים[13].
במחלות ניווניות שונות מתרחש מוות של תאים השייכים למסלולים או למערכות עצביות ספציפיות. למשל, מחלת אלצהיימר מאופיינת באיבוד נוירונים וקשרים סינפטיים ומערבת את המערכת הכולינרגית (האחראית על העברת אצטיל-כולין) באזורים שונים במוח. הטיפול כיום הוא סימפטומטי וכולל מעכבי אצטיל-כולינאסטרזות המגבירים את תפקוד המערכת הכולינרגית, אך עוזרים רק באופן חלקי וזמני. ייתכן והפתרון טמון בטיפול תאי שישמר או יחליף תאי עצב בעלי מומחיות שונה ובאזורי מוח שונים[13]. טיפול תאי נראה ריאלי יותר במחלת פרקינסון, בה התהליך הניווני מוגבל בעיקר לתאים דופמינרגיים ב-Dentate Gyrus. הטיפול כיום מתבסס בעיקר על מתן תכשירים היעילים רק לחלק מהסימפטומים אך בעלי תופעות לוואי רבות ואינם עוצרים את הידרדרות המחלה. השתלת תאי עצב דופמינרגיים לגרעיני הבסיס עשויה להשפיע על חלק ניכר מסימני המחלה[13].
הצלחת הטיפול התאי תלויה בגורמים רבים שכן במחלות ניווניות נפגעות אוכלוסיות תאים שונות ויש צורך להשתיל בכל מחלה סוג מסוים של תאים. תנאי נוסף להצלחת הטיפול הוא יכולת הישרדות ארוכת טווח של התאים. תנאים אלו קשים להשגה כיוון שנוירונים ואוליגודנדרוציטים ממוינים אינם מסוגלים לנדוד ושרידותם במוח הבוגר נמוכה מאוד[13].
המחקר בתחום עדיין עוסק בשיפור שרידות התאים, בהדגמת יכולתם להשתלב ברקמה, ליצור קשרים מתאימים, להפריש דופמין ולהביא להחלמה מסימני המחלה, אך מתוצאותיו ברור כי תאי גזע יכולים להשפיע על המוח המושתל דרך התמיינות והחלפת התאים הפגועים. רק בסיום שלב מחקרי זה אפשר יהיה להתקדם לניסויים פרה-קליניים וקליניים[13].
התקדמות המחקר מחזקת את התקווה שניתן יהיה לפתח אסטרטגיה של השתלות תאים לשם שחזור תפקודי של המוח וחוט השדרה[13].
ראו גם
[עריכת קוד מקור | עריכה]קישורים חיצוניים
[עריכת קוד מקור | עריכה]הערות שוליים
[עריכת קוד מקור | עריכה]- ^ Ming, G. L., & Song, H. (2005). Adult neurogenesis in the mammalian central nervous system. Annual Review of Neuroscience,28, 223-250.
- ^ Ashutosh Kumar, Vikas Pareek, Muneeb A. Faiq, Sanjib K. Ghosh, Chiman Kumari, ADULT NEUROGENESIS IN HUMANS: A Review of Basic Concepts, History, Current Research, and Clinical Implications, Innovations in Clinical Neuroscience 16, 2019-05-01, עמ' 30–37
- ^ 1 2 3 4 5 6 7 8 9 פרלמוטר, ד' (2014). מוח לבן : האמת המפתיעה על חיטה, פחמימות וסוכרים - הרוצחים השקטים של המוח. תל אביב: דיונון הוצאה לאור מבית פרובוק בע"מ.
- ^ Joseph Altman, Gopal D. Das, Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats, The Journal of Comparative Neurology 124, 1965-06, עמ' 319–335 doi: 10.1002/cne.901240303
- ^ 1 2 3 [null Goldstein, E. B. (2010). Encyclopedia of perception] (pp.181-198). Newcastle: Sage.
- ^ 1 2 3 4 5 6 7 8 [null Freberg, L. (2009). Discovering biological psychology (pp.124-157). Wadsworth: Cengage Learning.]
- ^ 1 2 3 4 Rodríguez, J. J., & Verkhratsky, A. (2011). Neurogenesis in Alzheimer’s disease. Journal of Anatomy, 219(1), 78-89.
- ^ 1 2 3 ^Thuret, S., Toni, N., Aigner, S., Yeo, G. W., & Gage, F. H. (2009). Hippocampus‐dependent learning is associated with adult neurogenesis in MRL/MpJ mice. Hippocampus, 19(7), 658-669.
- ^ Marxreiter, F., Regensburger, M., & Winkler, J. (2013). Adult neurogenesis in Parkinson’s disease. Cellular and molecular life sciences, 70(3), 459-473.
- ^ Shors, T. J. (2003). Can new neurons replace memories lost? Science's SAGE KE, 2003(49), 35-46.
- ^ 1 2 3 Sahay, A., & Hen, R. (2007). Adult hippocampal neurogenesis in depression. Nature neuroscience, 10(9), 1110-1115.
- ^ Lucassen, P. J., Meerlo, P., Naylor, A. S., Van Dam, A. M., Dayer, A. G., Fuchs, E., & Czeh, B. (2010). Regulation of adult neurogenesis by stress, sleep disruption, exercise and inflammation: Implications for depression and antidepressant action. European Neuropsychopharmacology, 20(1), 1-17.
- ^ 1 2 3 4 5 6 7 8 איינשטיין, א' (2007). השתלת תאי גזע במחלות נוירו-דגנרטיביות. אוחזר מתוך: TheMedical - אתר הרופאים של ישראל | השתלת תאי גזע במחלות נוירודגנרטיביות, באתר www.themedical.co.il
